Europejska Czerwona Lista i Europejska Czerwona Księga
Zagrożona bioróżnorodność, zagrożone życie Europy i Świata Część 1. / 08.03.2025 r.
Według Europejskiej Czerwonej Listy 25,0% ocenionych gatunków jest zagrożone wyginięciem w Europie
Europejska Czerwona Lista i Europejska Czerwona Księga – kluczowe narzędzia ochrony przyrody
Różnica między Europejską Czerwoną Listą a Europejską Czerwoną Księgą
Krytycznie zagrożone gatunki występujące w Polsce i Europie (CR)
SSaki
Chomik europejski. Common Hamster (Cricetus Cricetus)
Norka europejska (Mustela lutreola)
Suseł perełkowany. Susłek plamisty. Wiewiórka naziemna. (Speckled Ground Squirrel (Spermophilus suslicus)
Ptaki
Burzyk balearski (Puffinus mauretanicus)
Kulik cienkodzioby. (Numenius tenuirostris)
Orzeł stepowy. Steppe Eagle (Aquila nipalensis)
Towarzyska czajka. Sieweczka towarzyska Sociable Lapwing. (Vanellus gregarius)
Trznadel złotawy. Trznadel żółtobrzuchy (Emberiza aureola)
Ryby
Allis Shad. Aloza Finta. Aloza. Śledź Rzeczny (Alosa alosa)
Węgorz europejski. European eel (Anguilla Anguilla)
Rośliny
Fruchtbares Schlafmoos, (Hypnum fertile). Mszaki
Jesion pensylwański. Jesion omszony. Zielony Jesion. Green Ash (Fraxinus pennsylvanica).
źródła
Europa charakteryzuje się niezwykle bogatym i zróżnicowanym dziedzictwem naturalnym, obejmującym zarówno tundrę Skandynawii, alpejskie łańcuchy górskie, jak i śródziemnomorskie wybrzeża. Rozciągając się na różnorodne strefy klimatyczne – od subarktycznej na północy po subtropikalną na południu – kontynent ten jest domem dla tysięcy gatunków roślin i zwierząt, które wspólnie tworzą unikalną mozaikę ekosystemów.
Europejska bioróżnorodność obejmuje zarówno ikoniczne gatunki, takie jak niedźwiedź brunatny (Ursus arctos) czy żubr (Bison bonasus), jak i mniejsze, często niedoceniane organizmy, które odgrywają kluczową rolę w utrzymaniu równowagi ekologicznej. Lasy liściaste Europy Zachodniej, rozległe torfowiska Europy Północnej czy delikatne ekosystemy wydm nadbałtyckich stanowią nie tylko ostoję dla dzikiej przyrody, ale także źródło niezbędnych usług ekosystemowych – od oczyszczania powietrza i wody po regulację klimatu.
Ochrona tego bogactwa przyrodniczego ma fundamentalne znaczenie, zarówno dla zachowania różnorodności biologicznej, jak i dla jakości życia ludzkiego. Programy takie jak Natura 2000, rezerwaty biosfery UNESCO czy krajowe parki narodowe odgrywają kluczową rolę w zabezpieczaniu cennych siedlisk i gatunków przed degradacją. Jednocześnie, zrozumienie wartości przyrody i promowanie działań na rzecz jej ochrony przynosi korzyści nie tylko środowisku, ale także kulturze, gospodarce i przyszłym pokoleniom, zapewniając zrównoważony rozwój całego kontynentu.
Europejska Czerwona Lista i Europejska Czerwona Księga – kluczowe narzędzia ochrony przyrody
Europa jest domem dla tysięcy gatunków roślin i zwierząt, które tworzą niezwykle zróżnicowane ekosystemy. Niestety, wiele z nich jest zagrożonych w wyniku działalności człowieka, zmian klimatycznych i degradacji siedlisk. Aby skutecznie monitorować stan zagrożenia gatunków i wdrażać działania ochronne, opracowano Europejską Czerwoną Listę oraz Europejską Czerwoną Księgę.
Europejska Czerwona Lista – identyfikacja zagrożonych gatunków
Europejska Czerwona Lista to inicjatywa oceniająca stopień zagrożenia gatunków występujących w Europie, zgodnie z wytycznymi Międzynarodowej Unii Ochrony Przyrody (IUCN). Identyfikuje gatunki najbardziej narażone na wyginięcie na poziomie regionalnym, co umożliwia podejmowanie skutecznych działań ochronnych.
Kluczowe ustalenia Europejskiej Czerwonej Listy:
- Ssaki – 15% gatunków ssaków w Europie jest zagrożonych wyginięciem, 27% populacji wykazuje tendencję spadkową, a dla 33% brak wystarczających danych.
- Ptaki – spośród 544 gatunków ptaków regularnie występujących w Europie, 13% jest zagrożonych wyginięciem.
- Drzewa – z 454 rodzimych gatunków drzew w Europie aż 42,3% jest zagrożonych wyginięciem, głównie z powodu wylesiania, chorób oraz zmian klimatycznych.
- Mszaki (mchy, wątrobowce i glewiki) – pierwsza kompleksowa ocena tej grupy wykazała, że wiele z nich jest zagrożonych wyginięciem.
- Ślimaki lądowe – w Europie występuje 2 480 gatunków ślimaków lądowych, z których 11 nie jest rodzimych dla tego regionu.
- Ryby morskie – ocena wszystkich rodzimych europejskich gatunków ryb morskich pomogła zidentyfikować najbardziej zagrożone populacje.
- Siedliska – Europejska Czerwona Lista Siedlisk analizuje ryzyko zaniku siedlisk morskich, lądowych i słodkowodnych w Unii Europejskiej oraz regionach przyległych, dostarczając danych niezbędnych do ich ochrony.
Europejska Czerwona Księga – kompleksowa ocena ochrony gatunków
Od 2005 roku Europejska Czerwona Księga jest kluczowym narzędziem oceny stanu ochrony gatunków w Europie. Opracowana zgodnie z metodologią IUCN, nie tylko podnosi świadomość na temat zagrożeń, ale także dostarcza decydentom rzetelnych danych niezbędnych do kształtowania polityki ochrony przyrody.
Dzięki finansowaniu ze środków Komisji Europejskiej oceniono dotychczas niemal 16 000 taksonów, obejmujących gatunki, podgatunki i odmiany. Analiza objęła:
- Wszystkie gatunki kręgowców, w tym ssaki, ptaki, gady, płazy i ryby.
- Wiele grup bezkręgowców, m.in. mięczaki lądowe i wodne, ważki, motyle, pszczoły, koniki polne, świerszcze i świerszcze krzaczaste.
- Rośliny i grzyby, w tym drzewa, rośliny lecznicze, mszaki (mchy, wątrobowce i rogatki), bzygi, paprotniki (paprocie i widłaki), a także wybrane chrząszcze saproksyliczne i krzewy endemiczne.
- Rośliny naczyniowe, w tym dzikich krewnych roślin uprawnych oraz tzw. taksony „polityczne” – gatunki wymienione w międzynarodowych dokumentach ochrony przyrody, takich jak Dyrektywa Siedliskowa UE.
Znaczenie Europejskiej Czerwonej Listy i Księgi
Oba dokumenty odgrywają kluczową rolę w ochronie przyrody, dostarczając naukowych podstaw do opracowywania strategii ochronnych oraz monitorowania stanu różnorodności biologicznej. Dane te są wykorzystywane przez rządy, organizacje międzynarodowe i naukowców, wspierając działania na rzecz ochrony zagrożonych gatunków i siedlisk.
W obliczu rosnących zagrożeń dla bioróżnorodności Europejska Czerwona Lista i Europejska Czerwona Księga pomagają kształtować politykę ochrony środowiska i przyczyniają się do długoterminowego zachowania ekosystemów dla przyszłych pokoleń.
Różnica między Europejską Czerwoną Listą a Europejską Czerwoną Księgą
Chociaż Europejska Czerwona Lista i Europejska Czerwona Księga często są mylone, pełnią różne funkcje i mają inne zakresy działania. Oto kluczowe różnice:
| Cecha | Europejska Czerwona Lista | Europejska Czerwona Księga |
|---|---|---|
| Cel | Ocena stanu zagrożenia gatunków w Europie zgodnie z kryteriami IUCN. | Szczegółowa analiza i dokumentacja stanu ochrony gatunków w Europie. |
| Zakres | Identyfikacja gatunków zagrożonych wyginięciem na poziomie regionalnym. | Kompleksowa ocena i rekomendacje dotyczące ochrony gatunków. |
| Metodologia | Opiera się na kryteriach Czerwonej Listy IUCN, ocenia ryzyko wyginięcia. | Zawiera bardziej szczegółowe informacje o ekosystemach, trendach populacyjnych i zagrożeniach. |
| Zakres taksonomiczny | Dotyczy szerokiego zakresu grup organizmów, w tym roślin, zwierząt i siedlisk. | Skupia się głównie na gatunkach zwierząt i roślin wymagających szczególnej ochrony. |
| Znaczenie praktyczne | Pomaga w identyfikacji priorytetów ochrony oraz monitorowaniu bioróżnorodności. | Stanowi narzędzie dla naukowców, polityków i organizacji ochrony środowiska do wdrażania strategii ochronnych. |
| Częstotliwość aktualizacji | Regularnie aktualizowana w miarę dostępności nowych danych. | Opracowywana rzadziej, ale zawiera bardziej pogłębione informacje. |
- Europejska Czerwona Lista to szybkie i szerokie narzędzie oceny zagrożenia, które pozwala określić, jakie gatunki są najbardziej narażone na wyginięcie i wymagają pilnych działań ochronnych.
- Europejska Czerwona Księga to bardziej szczegółowe opracowanie, zawierające kompleksowe dane na temat trendów populacyjnych, siedlisk i zagrożeń dla gatunków, często wykorzystywane do tworzenia polityk ochrony przyrody.
W Polsce wiele gatunków zwierząt znajduje się na krawędzi wyginięcia, a ich populacje systematycznie maleją. Poniżej przedstawiam niektóre z tych gatunków, pogrupowane według kategorii zagrożenia:
Krytycznie zagrożone gatunki występujące w Polsce (CR) zawiera 11 gatunków ssaków (3), ptaków (5), ryb (2), roślin (2)
SSAKI

1. Chomik europejski. Common Hamster (Cricetus cricetus)
Chomik europejski Cricetus cricetus został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2019 r. Cricetus cricetus jest gatunkiem krytycznie zagrożonym.
W ostatnich latach nastąpił gwałtowny spadek wskaźnika reprodukcji. Szacuje się, że populacja zmniejsza się o 50% rocznie w dużych częściach swojego zasięgu, co oznacza redukcję o co najmniej 99% w ciągu najbliższych dziesięciu lat. Jeśli ten trend się utrzyma, gatunek może wyginąć w latach 2020–2050.
Zasięg występowania
Chomik europejski (Cricetus cricetus) ma szeroki zasięg globalny, obejmujący Europę Zachodnią, Środkową i Wschodnią, a także Rosję i Kazachstan. Jego wschodnia granica występowania sięga aż do rzeki Jenisej w azjatyckiej części Rosji. Chomik europejski zamieszkuje tereny od poziomu morza do wysokości 650 m n.p.m.
W Europie gatunek ten występuje od Belgii, Holandii i wschodniej Francji (Alzacji) na zachodzie, aż po Rosję na wschodzie. Jego północna granica obejmuje centralne Niemcy, Polskę i Rosję, a południowa rozciąga się do Bułgarii.
Zasięg występowania chomika europejskiego drastycznie się skurczył w niemal wszystkich krajach europejskich. Odnotowano lokalne i regionalne wyginięcia w 13 krajach Europy, a także w europejskiej i azjatyckiej części Rosji, co oznacza, że gatunek zanikł w 67% państw swojego pierwotnego zasięgu. Spadek populacji dotyczy nie tylko Europy Zachodniej, ale także całego globalnego obszaru występowania, co potwierdzają dane z Rosji i wschodnich części zasięgu.
Spadek zasięgu i populacji
Chomik europejski (Cricetus cricetus) odnotował znaczne spadki liczebności i zasięgu w Europie Zachodniej, Środkowej i Wschodniej, a jego populacje stały się silnie rozdrobnione. Proces ten obejmuje cały obszar występowania gatunku. Lokalne i regionalne wyginięcia miały miejsce m.in. w Belgii, Holandii, Francji, Austrii, Niemczech, Polsce, Czechach, na Węgrzech, Słowacji, Ukrainie, Białorusi i w Rosji.
Gatunek wymarł w Szwajcarii oraz prawdopodobnie w Gruzji. Luksemburg został błędnie uznany za obszar jego występowania w poprzednich ocenach.
We wszystkich krajach, gdzie prowadzono monitoring, odnotowano drastyczny spadek populacji. Przed 1970 r. chomik europejski był liczny w 28 prowincjach, pospolity w 37, a rzadki w 20. Obecnie liczny jest tylko w ośmiu, pospolity w 27, rzadki w 42, a w ośmiu prowincjach wymarł.
Zasięg gatunku stał się silnie rozdrobniony – zniknął z ponad 75% obszaru Europy Środkowej i Wschodniej. Największe skupiska populacji zachowały się we wschodniej Ukrainie, na Kaukazie, w rejonie Wołgi i Uralu oraz na Syberii. Jednak spadek populacji i fragmentacja obejmują także wschodnią część zasięgu.
Chomik europejski w Polsce
Chomik europejski (Cricetus cricetus) występuje w Polsce, jednak jego populacja znacznie się zmniejszyła w ostatnich dekadach. Dawniej był szeroko rozpowszechniony na terenach Południowej i Środkowej Polski, szczególnie w regionach o urodzajnych glebach, takich jak Lubelszczyzna, Małopolska, Wielkopolska i Dolny Śląsk.
Obecnie jego zasięg jest silnie rozdrobniony, a populacje znajdują się pod dużą presją. Główne przyczyny spadku to intensyfikacja rolnictwa, stosowanie pestycydów, zanik tradycyjnych metod uprawy oraz przekształcanie siedlisk. Chomik europejski jest objęty ścisłą ochroną gatunkową w Polsce
Siedlisko i Ekologia Chomika Europejskiego
Chomik europejski preferuje żyzne stepy i łąki, ale z powodzeniem zasiedla także tereny antropogeniczne, takie jak pola uprawne (zwłaszcza zboża), skraje pól, pobocza dróg oraz zarośnięte odłogiem obszary na farmach. Wschodnia część jego zasięgu obejmuje również ogrody i sady, gdzie gatunek często występuje w bliskim sąsiedztwie ludzkich siedlisk. Chomik jest liczniejszy w siedliskach antropogenicznych niż na naturalnych łąkach.
Preferuje gleby głębokie i ciężkie, w których kopie rozległe nory. Jego dieta składa się głównie z zielonych części roślin i nasion, a także uzupełniana jest przez bezkręgowce i czasami małe kręgowce. W przypadku dużych zagęszczeń może stanowić szkodnika rolniczego w niektórych rejonach.
Zagrożenia dla Chomika Europejskiego
Globalny spadek liczebności chomika europejskiego jest wynikiem złożonych i nie do końca zrozumianych przyczyn. W Europie Zachodniej przypisuje się go intensyfikacji rolnictwa i prześladowaniom, w tym utracie siedlisk oraz ich fragmentacji, wynikającej z budowy terenów przemysłowych i infrastruktury. Fragmentacja prowadzi do izolacji populacji, co negatywnie wpływa na ich dynamikę oraz różnorodność genetyczną.
Intensyfikacja rolnictwa, szczególnie zmiana upraw i stosowanie pestycydów, również stanowi zagrożenie. W Alzacji zaobserwowano spadek masy ciała chomików o 20% w ciągu ostatnich 70 lat, co powiązane jest z monokulturami kukurydzy oraz zmianami klimatycznymi.
Zmiana praktyk rolniczych w Europie Środkowej i Wschodniej również może stanowić poważne zagrożenie w przyszłości. Ponadto, historyczne prześladowania, takie jak łapanie i trucie chomików w celu ochrony upraw oraz handel futrami, miały negatywny wpływ na ich populacje.
Spadek liczby miotów oraz zmniejszenie liczby zarodków i noworodków sugeruje, że populacje mogą kurczyć się o 50% rocznie. Zmiana klimatu, zanieczyszczenie światłem oraz wpływ łapania na futra mogą być głównymi przyczynami tego spadku. Zanieczyszczenie światłem wpływa na fizjologię chomika, zmieniając jego cykle reprodukcyjne. W obszarach o dużym zanieczyszczeniu światłem zaobserwowano czasową zbieżność spadku populacji z intensyfikacją zanieczyszczenia.
Mimo to, niektóre populacje dobrze funkcjonują w miastach, gdzie lepsza dostępność pożywienia i schronienie przed deszczem mogą łagodzić negatywne skutki zanieczyszczenia światłem.
W przeszłości chomiki zwyczajne były intensywnie odławiane w celu handlu futrami, z rocznym odłowem wynoszącym dziesiątki milionów osobników. Ta presja łowiecka ustała w latach 70. XX wieku na większości obszarów ich występowania. Obecnie polowania na chomiki nadal mają miejsce jedynie na Węgrzech.

2. Norka europejska (Mustela lutreola)
Norka europejska Mustela lutreola została ostatnio oceniona pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2015 r. Mustela lutreola jest uznawana za gatunek krytycznie zagrożony
Norka europejska (Mustela lutreola) to jeden z najbardziej zagrożonych ssaków Europy. Od połowy XIX wieku jej zasięg zmniejszył się o ponad 85%, a populacja w ciągu XX wieku spadła o ponad 90%. Główne zagrożenia dla gatunku to utrata siedlisk, konkurencja ze strony inwazyjnej norki amerykańskiej (Neovison vison) oraz polowania.
Wygląd, tryb życia i rozmnażanie
Norka europejska to niewielki, smukły drapieżnik o długości ciała 30–43 cm (samce są większe od samic) i ogonie mierzącym 12–19 cm. Waży od 400 do 900 g. Jej futro jest ciemne, brązowe lub czekoladowe, z charakterystyczną białą plamą na górnej i dolnej wardze, co odróżnia ją od inwazyjnej norki amerykańskiej, która ma białą plamę wyłącznie na dolnej wardze lub w ogóle jej nie posiada. Posiada krótkie łapy z błonami między palcami, które ułatwiają pływanie. Jej ciało jest elastyczne, co pozwala jej sprawnie poruszać się w wodzie i w gęstej roślinności.
Norka europejska prowadzi samotniczy tryb życia i zamieszkuje brzegi rzek, strumieni oraz jezior. Preferuje gęsto porośnięte tereny, a na otwartych przestrzeniach pojawia się rzadko. Zazwyczaj przebywa w pobliżu wody – rzadko oddala się na więcej niż 100 metrów. Jest aktywna głównie o zmierzchu i w nocy.
Żywi się małymi ssakami, rybami, żabami, rakami, owadami oraz ptactwem, w tym także drobiem. Poluje zarówno na lądzie, jak i w wodzie, wykorzystując swoje umiejętności pływackie.
Rozród
- Okres godowy przypada na zimę.
- Ciąża trwa około 45 dni, po czym samica rodzi 2–7 młodych.
- Młode osiągają dojrzałość płciową po 9 miesiącach i usamodzielniają się po kilku miesiącach.
Dzięki doskonałemu przystosowaniu do życia w środowisku wodnym i zwinności norka europejska była niegdyś powszechna w Europie, jednak jej populacja drastycznie zmniejszyła się z powodu degradacji siedlisk i konkurencji ze strony norki amerykańskiej.
Zasięg geograficzny i liczebność populacji:
Niegdyś szeroko rozpowszechniona, obecnie norka europejska przetrwała jedynie w kilku izolowanych enklawach:
- Delta Dunaju (Rumunia) – największa populacja, licząca 1000–1500 osobników.
- Północna Hiszpania i zachodnia Francja – skrajnie małe, rozdrobnione populacje.
- Rosja, Ukraina, Kaukaz – nieliczne populacje w zaniku, często w obszarach z obecnością norki amerykańskiej.
- Estonia (wyspa Hiiumaa) – reintrodukowana populacja poniżej 100 osobników.
W Polsce, Niemczech, krajach bałtyckich oraz większości Europy Środkowej i Wschodniej gatunek uznawany jest za wymarły.
Główne zagrożenia:
- Norka amerykańska – wypiera norkę europejską poprzez konkurencję o zasoby i agresję wewnątrzgatunkową.
- Degradacja siedlisk – osuszanie mokradeł, regulacja rzek i urbanizacja.
- Nadmierna eksploatacja w XX wieku – intensywne polowania doprowadziły do drastycznego zmniejszenia populacji.
- Niska różnorodność genetyczna – szczególnie w populacjach zachodnich, co osłabia odporność na choroby i zmiany środowiskowe.
Działania ochronne:
- Programy hodowli zachowawczej – prowadzone w Estonii, Hiszpanii, Francji i Niemczech. W ramach programu EEP w niewoli znajduje się ok. 250 osobników.
- Kontrola norki amerykańskiej – intensywne działania w Hiszpanii pozwoliły usunąć ponad 5500 osobników, zapobiegając dalszej ekspansji.
- Reintrodukcje i monitorowanie – populacja na wyspie Hiiumaa w Estonii oraz badania w delcie Dunaju.
Reintrodukcja norki europejskiej w Polsce
W związku z krytycznym zagrożeniem wyginięcia norki europejskiej, podejmowane są działania mające na celu przywrócenie jej do naturalnych siedlisk. Jednym z potencjalnych miejsc reintrodukcji tego gatunku może stać się Park Narodowy Doliny Dolnej Odry, który jest w trakcie ustanawiania.
Nad powrotem norki europejskiej do Polski od lat pracują naukowcy i aktywiści z Uniwersytetu Szczecińskiego oraz Polskiego Towarzystwa Genetyki Konserwatorskiej LUTREOLA, w szczególności dr Jacek Skorupski. Badacze ci dokonali przełomowego osiągnięcia, zsekwencjonowali genom norki europejskiej, działając jako liderzy międzynarodowego konsorcjum naukowego. To odkrycie dostarcza kluczowych informacji na temat genetyki gatunku, co może pomóc w skutecznej ochronie i reintrodukcji. Dolina Dolnej Odry, z rozległymi terenami podmokłymi, rozbudowaną siecią starorzeczy i obfitością naturalnych siedlisk, stanowi idealne środowisko dla norki europejskiej. Jeśli reintrodukcja zakończy się sukcesem, może to być pierwszy krok do odbudowy populacji tego gatunku w Polsce.
Norka europejska to jeden z najbardziej zagrożonych ssaków Europy. Jej populacja skurczyła się o ponad 90%, a prognozy pozostają pesymistyczne. Bez skoordynowanych działań ochronnych, eliminacji norki amerykańskiej i odbudowy siedlisk gatunek ten może wkrótce zniknąć całkowicie.

3. Suseł perełkowany. Susłek plamisty. Wiewiórka naziemna. Speckled Ground Squirrel (Spermophilus suslicus)
Wiewiórka suseł Spermophilus suslicus została ostatnio oceniona pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2023 r. Spermophilus suslicus jest wymieniony jako gatunek krytycznie zagrożony.
Wiewiórka naziemna ma ciemnobrązowe futro z białymi plamkami na grzbiecie i krótki, cienki ogon. Dorasta do długości 25 cm (10 cali) i waży 280 g (10 uncji). Jej wzór zębowy to1.0.2.31.0.1.3Jest mniejszy i mniej towarzyski niż wiele innych wiewiórek ziemnych z rodzaju Spermophilus .
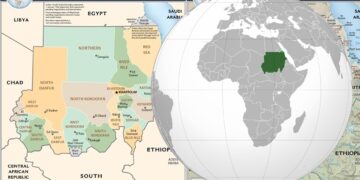
Susłek plamisty jest endemiczny dla Europy Wschodniej, gdzie występuje w południowo-wschodniej Polsce, niewielkich obszarach na Białorusi, Ukrainie, w Mołdawii i Rosji na wschód od rzeki Wołgi. W Polsce susłek występuje na zachodnim krańcu swojego zasięgu i jest znany z jednej reliktowej enklawy położonej między rzekami Wieprz i Bug w rejonie Zamościa. Jest to gatunek nizinny, występujący do wysokości nie większej niż 500 m (I. Zagorodnyuk pers. comm. 2006).
Siedlisko:
Gatunek ten żyje w gęstych koloniach na pastwiskach porośniętych niską trawą i często występuje w pobliżu źródeł wody. Na przykład wszystkie aktywne populacje w Mołdawii znajdują się w odległości mniejszej niż 100 metrów od bieżącej wody. Jest również powszechnie spotykana na miejskich cmentarzach, lotniskach i poboczach dróg. W przeszłości ta wiewiórka ziemna zamieszkiwała również grunty orne, ale wydaje się, że już tak nie jest. Ogólnie rzecz biorąc, brak wypasu prowadzi do szybkiej degradacji siedlisk i ostatecznie do spadku populacji.
Hibernacja i aktywność:
Wiewiórka plamista hibernuje i jest aktywna od lutego-marca do lipca-listopada.
Dieta:
Żywi się głównie zieloną trawą i wiadomo, że czasami zjada zboża (głównie dzikie, rzadko uprawne). Wczesnym latem żywi się również różnymi chrząszczami, które mogą stanowić znaczną część jego diety.
Rozmnażanie:
Gatunek ten rozmnaża się raz w roku, rodząc od dwóch do ośmiu młodych.
Dramatyczny spadek populacji susełka plamistego
Susełek plamisty to jeden z najbardziej zagrożonych gryzoni w Europie. W ciągu ostatnich 30–50 lat jego globalna populacja zmniejszyła się o ponad 99%, a trend spadkowy nadal się utrzymuje. Od 2015 roku gatunek traci średnio 30% populacji rocznie, co oznacza ponad 90% spadek w ciągu ostatnich 10 lat.
Sytuacja w Polsce
W Polsce najnowsze szacunki wskazują na około 9000 osobników, jednak większość populacji jest skupiona w kilku lokalizacjach. Największa kolonia na lotnisku w Świdniku upadła w latach 2008–2009. W 2015 roku 94% całkowitej populacji w kraju znajdowało się w koloniach w pobliżu Popówki i Suslich Wzgórz.
Białoruś
Gatunek przetrwał w kilku małych koloniach w pobliżu miasta Nieśwież, gdzie w 2021 roku odnotowano około 5000 aktywnych nor (Shokalo, 2022). Niestety, regularne monitorowanie populacji od 2019 roku wykazało coroczną utratę subpopulacji.
Ukraina
Sytuacja na Ukrainie jest krytyczna – ponad 99% populacji wymarło.
- Małe, izolowane kolonie występują w zachodniej Ukrainie (w pobliżu miast Brody i Sokal) oraz w rejonie Charkowa (Viter, 2020).
- W Mikołajowie kilka subpopulacji wyginęło – w 2019 r. szacowano tam mniej niż 100 dorosłych osobników.
- Największa kolonia w Odessie (Sowinon) upadła po zabudowie terenów siedliskowych po 2015 roku.
- Kilka dużych kolonii w południowej Besarabii (obwód odeski) upadło w latach 2015–2019 – obecnie przetrwały jedynie niewielkie grupy, liczące mniej niż 100 osobników.
- Największa kolonia w Oczakowie (obwód mikołajowski) liczyła 1000 osobników w 2015 r., ale jej obszar zajmowany zmniejszył się trzykrotnie w 2019 r., co doprowadziło do załamania populacji.
Mołdawia
W Mołdawii przetrwało 5–6 niewielkich populacji, każda licząca mniej niż 100 osobników. Kilka kolonii załamało się po katastrofalnych powodziach w latach 2017–2018.
Rosja
W Rosji gatunek doświadczył drastycznego spadku w ciągu ostatnich 10–15 lat, a wiele kolonii wyginęło.
- Susełek wymarł w obwodach moskiewskim, biełgorodzkim, rostowskim, wołgogradzkim, saratowskim, orelskim, tulskim i penzeńskim.
- Mała, izolowana populacja przetrwała w regionie briańskim.
- Jedna z największych kolonii znajduje się na cmentarzu miejskim w Lipiecku.
Zagrożenia
Susełek plamisty jest gatunkiem zagrożonym głównie z powodu utraty i fragmentacji siedlisk. Do najważniejszych przyczyn tego procesu należą ekspansja rolnictwa i leśnictwa, urbanizacja, rekultywacja nieużytków oraz rozwój przemysłu.
Zaoranie terenów zajmowanych przez kolonie oraz gromadzenie odpadów w siedliskach susełka doprowadziło do wyginięcia kilku subpopulacji na Białorusi w latach 2010–2021. W wyniku tych zmian populacje maleją i stają się coraz bardziej rozdrobnione, co ogranicza problem hybrydyzacji, ale prowadzi do izolacji genetycznej.
Zmiany klimatyczne stanowią dodatkowe zagrożenie dla susełka plamistego. Chłodniejsze zimy i zmniejszone opady w części jego zasięgu występowania doprowadziły do wzrostu śmiertelności. Ponadto, susze i regularne powodzie przyczyniły się do wyginięcia wielu subpopulacji w ciągu ostatnich 10 lat.
Obecnie najbardziej zróżnicowane genetycznie populacje występują w obwodzie odeskim (Ukraina) i w Mołdawii, podczas gdy populacje z centralnej Rosji, Białorusi i Polski wykazują znaczne zubożenie genetyczne.
Susełek plamisty zmaga się z wieloma zagrożeniami, w tym utrata siedlisk, negatywnymi skutkami zmian klimatycznych oraz rosnącą izolacją populacji. Ochrona tego gatunku wymaga zachowania i odtwarzania naturalnych terenów stepowych, ograniczenia presji rolnictwa oraz monitorowania wpływu zmian środowiskowych na jego populację.
Susełek plamisty znajduje się na granicy wymarcia. Jego populacja wciąż maleje na skutek utraty siedlisk, urbanizacji, zmian klimatycznych i braku skutecznych działań ochronnych. Ocalenie gatunku wymaga pilnych działań w zakresie ochrony siedlisk, monitorowania populacji i wdrażania programów reintrodukcji.
PTAKI

4. Burzyk Balearski. Balearic Shearwater. (Puffinus mauretanicus)
Burzyk balearski Puffinus mauretanicus został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2018 r. Puffinus mauretanicus jest wymieniony jako gatunek krytycznie zagrożony
opis.
Puffinus mauretanicus to średniej wielkości burzyk, osiągający długość 33 cm. Charakteryzuje się raczej ciemnym upierzeniem – górne partie ciała mają ciemnobrązową barwę, subtelnie kontrastującą z jaśniejszymi, nieregularnie ubarwionymi dolnymi partiami w odcieniach brązu i bieli. U większości osobników wyróżniają się ciemne pokrywy podogonowe oraz pachy.
Zasięg występowania
Puffinus mauretanicus rozmnaża się wyłącznie na Balearach (Hiszpania), obejmując pięć głównych grup wysp: Minorkę, Majorkę, Cabrerę, Ibizę i Formenterę. W sezonie lęgowym (od końca lutego do początku lipca) główne obszary żerowania znajdują się wzdłuż szelfu Morza Śródziemnego Półwyspu Iberyjskiego, zwłaszcza w rejonie środkowego wybrzeża Katalonii, delty Ebro-Columbretes i przylądka Nao. Niektóre osobniki żerują także u wybrzeży Algierii, Maroka i w Zatoce Lwiej oraz w wodach wokół Balearów.
Po okresie lęgowym większość populacji opuszcza Morze Śródziemne i latem oraz jesienią koncentruje się u wybrzeży Atlantyku w południowo-zachodniej Europie – głównie w Hiszpanii, Portugalii i Francji – a także w południowo-zachodniej Wielkiej Brytanii i północno-zachodnim Maroku. Jesienią (głównie w październiku) ptaki wracają do zachodniej części Morza Śródziemnego, gdzie spędzają zimę na tych samych obszarach żerowania co w okresie lęgowym.
Populacja z Minorki, wykazująca ślady dawnych krzyżowań z burzykiem yelkouańskim (Puffinus yelkouan), różni się od reszty gatunku pod względem migracji i fenologii rozrodu. Większość tych ptaków pozostaje w zachodniej części Morza Śródziemnego przez cały rok.
Szacunki populacji i trend spadkowy
W ciągu ostatnich dwóch dekad szacunki dotyczące populacji lęgowej Puffinus mauretanicus wynosiły od 2000 do 4500 par (Ruiz i Martí 2004, Arcos i in. 2011), a obecna oficjalna liczba to 3142 pary (ACAP 2012). Poszczególne wyspy zamieszkuje: Majorka – 900 par, Minorka – 405, Cabrera – 475, Ibiza – 650, Formentera – 712. Ze względu na trudny dostęp do miejsc lęgowych, szacunki te opierają się na metodach pośrednich (np. liczenie tratw, wokalizacje), co może prowadzić do znacznych błędów. Ponadto, różnice w metodologii badań i warunkach środowiskowych mogą wpływać na zmienność wyników w kolejnych latach.
Badania morskie, oparte na obserwacjach z łodzi i liczeniach przybrzeżnych w Cieśninie Gibraltarskiej, wskazują na globalną populację około 25 000 osobników, co sugeruje, że populacja lęgowa może być większa niż wcześniej zakładano. Na podstawie tych danych oszacowano populację lęgową na około 7200 par, jednak liczba ta wymaga dalszej weryfikacji.
Sytuacja w Polsce
Puffinus mauretanicus w Polsce pojawia się wyjątkowo rzadko jako ptak zalatujący. Jego naturalne siedliska znajdują się głównie na Morzu Śródziemnym, gdzie gniazduje na Balearach. W Polsce odnotowano jedynie pojedyncze przypadki obserwacji tego gatunku na Bałtyku.
Trend spadkowy i ryzyko wyginięcia
Oszacowano roczny spadek populacji na 7,4%, przewidując wyginięcie gatunku w ciągu 40 lat. Oznacza to spadek liczebności o ponad 80% w ciągu trzech pokoleń (54 lata). Nowsze modelowanie, uwzględniające dokładniejsze dane demograficzne i globalny szacunek populacji na poziomie 23 780 osobników, wskazuje na jeszcze szybszy spadek – około 14% rocznie. Jeśli ten trend się utrzyma, gatunek może wymrzeć w ciągu 61 lat.
Należy podkreślić, że te analizy zakładają populację w stanie równowagi na poziomie 7200 par, co nie zostało jeszcze potwierdzone. Jeśli rzeczywista liczba par lęgowych jest niższa, czas do wyginięcia może być jeszcze krótszy. Dodatkowo badania opierały się na kolonii wolnej od drapieżników, co oznacza, że średni wskaźnik przeżywalności populacji może być zawyżony.
Siedlisko i ekologia
Burzyk balearski gniazduje w jaskiniach, norach i szczelinach skalnych na przybrzeżnych klifach i wysepkach Balearów. Kolonie lęgowe są niewielkie, liczą od pojedynczych gniazd do kilkuset par. Gatunek jest filopatryczny – dorosłe osobniki przystępują do lęgów najwcześniej w trzecim roku życia, najczęściej między 4. a 6. rokiem. Jaja składane są w marcu, wykluwanie następuje w kwietniu-maju, a młode opuszczają gniazda na początku lipca (Ruiz i Martí 2004, Tan 2016).
Burzyk balearski nurkuje na głębokość ponad 35 m, żywiąc się głównie pelagicznymi rybami, organizmami planktonowymi oraz odrzutami z połowów (Arc. Odrzuty ryb wpływają na ekologię tego gatunku, m.in. sposób żerowania i cechy cyklu życiowego.
Na morzu preferuje przybrzeżne, produktywne wody szelfowe, szczególnie w pobliżu oceanograficznych frontów. W okresie lęgowym żeruje blisko kolonii, wykorzystując sprzyjające wiatry. Poza sezonem gniazdowania występuje w skupiskach, których lokalizacja zmienia się zależnie od dostępności ryb pelagicznych.
Zagrożenia
Burzyk balearski jest długowieczny, a głównym zagrożeniem dla populacji jest śmiertelność dorosłych osobników.
Przyłów w rybołówstwie – największe zagrożenie, odpowiadające za niemal 50% śmiertelności. Szczególnie niebezpieczne są przydenne długie linki, ale również inne narzędzia połowowe, jak włoki i sieci okrężne. Gatunek często towarzyszy kutrom, co może prowadzić do masowych śmiertelności.
Drapieżnictwo obcych gatunków – w ok. 25% kolonii występują szczury (Rattus rattus, R. norvegicus), dzikie koty (Felis catus) i żenetki (Genetta genetta), zagrażając ok. 38% populacji lęgowej. Koty powodują lokalne spadki populacji, szczury niszczą jaja i pisklęta, ale rzadziej atakują dorosłe osobniki.
Zanieczyszczenia i działalność człowieka – wycieki ropy mogą powodować masowe śmiertelności, a nadmierna eksploatacja ryb zmniejsza dostępność pokarmu. Inne zagrożenia to rozwój farm wiatrowych, zanieczyszczenie światłem dezorientujące młode ptaki oraz plastik w środowisku.
Zmiany klimatu i ekosystemu – przesuwanie się populacji poza sezonem lęgowym na północ może wpływać na przeżywalność, a zmiany w rozmieszczeniu ryb mogą wynikać zarówno z klimatu, jak i działalności rybackiej.
Pomimo zagrożeń zmienność genetyczna gatunku pozostaje wysoka, a łączność między koloniami zmniejsza ryzyko wyginięcia.
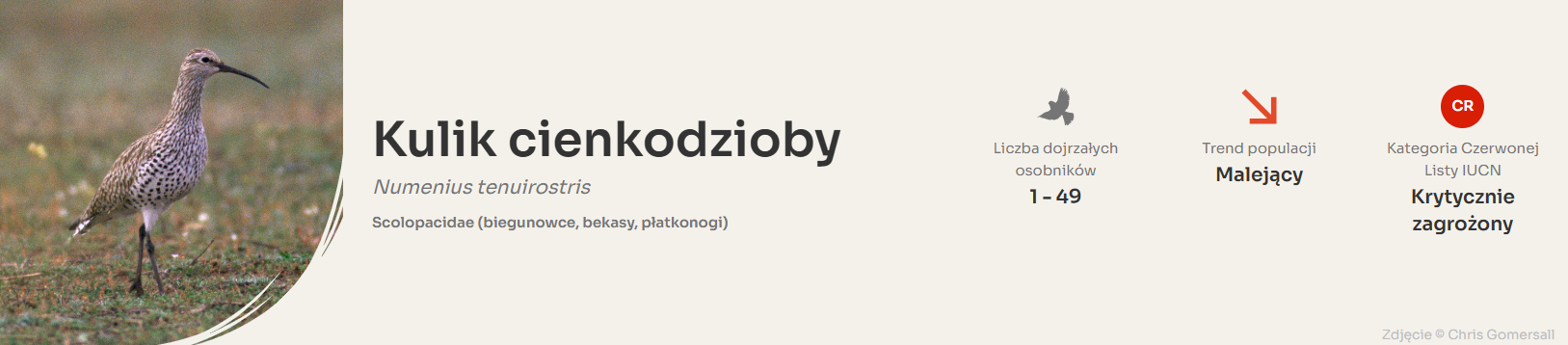
5. Kulik cienkodzioby. (Numenius tenuirostris)
Kulik cienkodzioby Numenius tenuirostris został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Numenius tenuirostris znajduje się na liście gatunków krytycznie zagrożonych
Opis
Numenius tenuirostris to niewielki kulik o długości 36–41 cm. Charakteryzuje się cętkowanym, brązowoszarym upierzeniem oraz białym spodem ciała. U dorosłych osobników na bokach widoczne są charakterystyczne, czarne, sercowate plamki. Wygięty dziób, całkowicie ciemny u dorosłych, zwęża się do wyraźnie cienkiego, ostrego końca z wąską podstawą. Ptak posiada krótkie, ciemnoszare nogi.
W locie zauważalne są jasne, prążkowane wewnętrzne lotki pierwszorzędowe i drugorzędowe, które kontrastują z brązowoczarnymi zewnętrznymi lotkami pierwszorzędowymi. Zawsze można również zaobserwować białe pokrywy podskrzydłowe oraz pachy. Kuper pozostaje praktycznie nieoznakowany, a ogon zdobią cztery do pięciu ciemnych pręg na białym tle. W odróżnieniu od kulika zwyczajnego (N. arquata), u Numenius tenuirostris we wszystkich stadiach życia brakuje poprzecznego pręgowania upierzenia.
Opis zakresu
Kulik cienkodzioby Numenius tenuirostris został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2018 r. Numenius tenuirostris jest wymieniony jako gatunek krytycznie zagrożony.
Numenius tenuirostris – gatunek, którego rozmnażanie potwierdzono jedynie w okolicach Tary, na północ od Omska na Syberii (Rosja) w latach 1909–1925. Jego domniemany obszar lęgowy obejmuje tereny Rosji, a następnie, podczas migracji, ptak ten kieruje się na południowy zachód przez centralną i wschodnią Europę. Na trasie tej przemieszczania się odnotowuje się występowanie w krajach takich jak Rosja, Kazachstan, Ukraina, Bułgaria, Węgry, Rumunia oraz w byłej Jugosławii, a następnie w południowej Europie – Grecji, Włoszech, Turcji – a także w północnej Afryce, m.in. w Algierii, Maroku i Tunezji.
Dodatkowo pojawiały się zgłoszenia dotyczące występowania tego gatunku w Słowenii, Uzbekistanie, Turkmenistanie, Arabii Saudyjskiej oraz Jemenie, natomiast doniesienia o ptakach obserwowanych na Ukrainie są nadal aktualne, choć wymagają potwierdzenia.
Historycznie, Numenius tenuirostris był bardzo powszechny na początku XIX wieku, jednak już w XX wieku stał się rzadkim gościem, a regularne zapisy obserwacyjne ustąpiły pod koniec stulecia. W latach 1980–1990 odnotowano jedynie 103 zapisy obejmujące 316–326 ptaków (BirdLife International 1999), a w kolejnym dziesięcioleciu liczba ta spadła do 74 rekordów dotyczących 148–152 osobników.
Mimo że pojawiały się doniesienia o większych grupach w Bułgarii, na Ukrainie i w Uzbekistanie, najnowsze zweryfikowane zapisy dotyczą zazwyczaj zaledwie jednego do trzech ptaków, przy czym ostatni krajowo uznany zapis pochodzi z Węgier z kwietnia 2001 roku.
W 1994 roku populację gatunku oszacowano na zaledwie 50–270 osobników, a brak nowszych potwierdzonych danych sugeruje, że obecnie liczba ta może być jeszcze mniejsza niż 50 ptaków.
Siedlisko i ekologia
Zachowanie
Gatunek ten jest wędrowny i rozmnaża się w małych koloniach. Gniazda ulokowane są w odległościach od 2 do 3 metrów, a także od 10 do 15 metrów od siebie, a jaja znajdowano najczęściej w maju. Wcześniejsze zapisy wskazują, że podczas migracji i zimowania występowały duże stada, jednak od kilku dekad obserwuje się jedynie pojedyncze osobniki lub niewielkie grupy. Szczyt jesiennej migracji przypada około września, a wiosennej – około marca (Gretton 1991).
Siedlisko
Znane gniazda lęgowe odnotowano wyłącznie w strefach przejściowych między bagnami a lasami, na północnej granicy strefy lasostepowej, w środowisku bardziej typowym dla bagien tajgi. Może to świadczyć o bardzo wyspecjalizowanych wymaganiach siedliskowych lub o unikalnym wykorzystaniu terenów na obrzeżach zasięgu lęgowego gatunku.
Podczas migracji i zimowania ptaki korzystają z różnorodnych siedlisk, m.in.:
- słonych bagien, wilgotnych łąk, stepów, stawów rybnych,
- salin, słonawej laguny, bagien pływowych,
- półpustyń, mokradeł oraz piaszczystych pól uprawnych w pobliżu lagun.
Szczególnie charakterystyczne są rozległe kompleksy przybrzeżnych terenów podmokłych, z których większość zapisów pochodzi z okolic morza. Zimując w głębi lądu, gatunek zamieszkuje bagna zasilane słodką wodą, choć obecność obszarów Salicornia wskazuje na wysoką zawartość soli w podłożu
Dieta
Informacji na temat diety tego ptaka jest niewiele. W rejonie Merja Zerga (Maroko) żywił się on dżdżownicami oraz larwami tipulidów, podczas gdy w innych lokalizacjach obserwowano spożycie owadów – istnieje nawet podejrzenie, że ortoskrzydłe mogły stanowić ważne źródło pożywienia (N. Crockford w litt. 2012). Odnotowano także przypadki żywienia się mięczakami i skorupiakami.
Sytuacja w Polsce:
- W przeszłości kulik cienkodzioby był rzadko obserwowany w Polsce jako ptak przelotny.
- Ostatnie wiarygodne obserwacje w Europie miały miejsce w latach 90. XX wieku.
- Gatunek ten jest obecnie uznawany za prawdopodobnie wymarły na wolności – przez ostatnie lata nie odnotowano pewnych obserwacji.
- W Polsce nie ma oficjalnego statusu ochrony, ponieważ od lat nie jest stwierdzany.
Zagrożenia
Główne zagrożenia dotyczą degradacji siedlisk. Lęgowe tereny w zasięgu tajgi, lasostepów i stepów zostały częściowo przekształcone pod uprawy, a osuszanie terenów podmokłych w basenie Morza Śródziemnego, Afryki Północnej i Iraku dodatkowo pogarsza sytuację. Historycznie intensywne łowiectwo oraz rozpad społecznych zachowań, typowych dla gatunku stadnego, utrudniają odbudowę populacji. Małe grupy lub pojedyncze osobniki mają trudności w znalezieniu odpowiednich miejsc postoju podczas migracji, co zwiększa ryzyko integracji z N. arquata i korzystania z nieodpowiednich siedlisk zimowych.

6. Orzeł stepowy. Steppe Eagle (Aquila nipalensis)
W Europie Orzeł stepowy Aquila nipalensis został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych IUCN w 2021 r. Aquila nipalensis znajduje się na liście gatunków krytycznie zagrożonych.
Na świecie Aquila nipalensis uznany jest za zagrożony.
Opis
Długość ciała wynosi 72–81 cm, a rozpiętość skrzydeł 160–200 cm. Jest to średniej wielkości, ciemnobrązowy orzeł. Młode osobniki charakteryzują się szerokim, białawym pasem wzdłuż większych pokryw podskrzydłowych. Lotki pierwszorzędowe są prążkowana tęczówka ma brązową barwę.
Podobne gatunki
Orzeł ten jest większy od orła sawannowego (Aquila rapax), a odróżnia go także szerokość i długość szpary dziobowej. W porównaniu do orła krzykliwego (Aquila pomarina) jest ogólnie ciemniejszy, natomiast jest jaśniejszy niż orzeł grubodzioby (Aquila clanga). Dodatkowo jego nozdrza mają owalny kształt, podczas gdy u dwóch ostatnich gatunków są one okrągłe.

7. Towarzyska czajka. Sieweczka towarzyska. Sociable Lapwing. (Vanellus gregarius)
Towarzyska czajka Vanellus gregarius została ostatnio wpisana na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2018 r. Vanellus gregarius jest wymieniony jako gatunek krytycznie zagrożony.
Czajka towarzyska (Vanellus gregarius) to średniej wielkości ptak z rodziny siewkowatych, charakteryzujący się długością ciała od 27 do 30 cm oraz rozpiętością skrzydeł wynoszącą 68–75 cm. W szacie godowej wyróżnia się czarną czapeczką na głowie z białą obwódką, czarnym pasem przez oko, szarym wierzchem ciała oraz rdzawym przodem brzucha. Ogon jest biały z czarną plamą na końcu, a nogi i dziób są ciemne.
Zachowanie i migracja
Czajka towarzyska jest gatunkiem wędrownym. Rozmnaża się półkolonialnie, tworząc małe grupy liczące od 3 do 20 par. Okres lęgowy przypada na połowę kwietnia do lipca, a migracja na południe rozpoczyna się w sierpniu lub wrześniu, choć niektóre ptaki odlatują dopiero w październiku.
Przed migracją stada liczące kilka tysięcy osobników zbierają się na Syberii i w Kazachstanie, jednak same przeloty odbywają się w mniejszych grupach, liczących 15–20 ptaków. W Syrii czajki pojawiają się od połowy lutego do końca marca, a jesienią są tam obserwowane w trakcie przelotów. Na zimowiska w Indiach i Pakistanie przybywają we wrześniu-październiku, a w Sudanie pod koniec października.
Podczas zimowania ptaki najczęściej przebywają w niewielkich stadach liczących od kilku do kilkudziesięciu osobników, choć sporadycznie odnotowywano większe grupy przekraczające 100 ptaków. Wiosenny odlot z zimowisk rozpoczyna się w marcu lub na początku kwietnia, a na tereny lęgowe ptaki wracają w połowie kwietnia.
Siedlisko
Czajka towarzyska preferuje strefy przejściowe między stepami trawiastymi (np. z roślinnością Stipa i Artemisia), w pobliżu zbiorników wodnych. Do lęgów wybiera suche nieużytki, pola uprawne, tereny zaorane oraz ścierniska.
- Gniazda są zakładane głównie w miejscach porośniętych bylicą, gdzie występuje niska roślinność i duża obfitość odchodów zwierząt, co może przyciągać owady, stanowiące podstawę diety piskląt.
- Unika gęsto porośniętych stepów, ale teren z niewielką ilością odsłoniętej ziemi i wyższą roślinnością jest ważny dla młodych, ponieważ zapewnia im schronienie przed drapieżnikami.
- W przeszłości czajki mogły korzystać z terenów wypasanych przez wędrowne suhaka stepowego (Saiga tatarica), jednak wpływ tych zwierząt na lęgowiska jest niepewny.
- Obecnie najliczniejsze populacje występują na obrzeżach wsi w Kazachstanie, gdzie intensywny wypas zwierząt gospodarskich może sprzyjać utrzymaniu optymalnych warunków do lęgów.
Podczas migracji ptaki preferują piaszczyste równiny z niską roślinnością, suche łąki, ugory oraz pola uprawne. Ich zimowiska obejmują wypalone stepy, sawanny, suche równiny, pustkowia, pola prosa i wilgotne pastwiska, często w pobliżu zbiorników wodnych.
Dieta
Czajka towarzyska żywi się głównie owadami, zwłaszcza prostoskrzydłymi (Orthoptera), chrząszczami (Coleoptera) oraz larwami motyli. Spożywa również pajęczaki oraz niewielkie ilości materii roślinnej, w tym ziarna, liście i kwiaty.
W żołądkach ptaków często znajdują się małe kamyki, a także resztki małych kręgowców i muszli mięczaków. Dieta jest bardziej urozmaicona w okresie lęgowym, natomiast poza sezonem rozrodczym ogranicza się głównie do owadów.
Rozród
- Gniazdo to zagłębienie w ziemi, które może być wyłożone roślinnością, kamykami lub innymi materiałami.
- Najczęściej znajduje się na gołej, słonej ziemi lub w niskiej roślinności w pobliżu wody.
- Przeżywalność jaj jest zmienna w zależności od sezonu i poziomu presji drapieżników, takich jak lis rudy (Vulpes vulpes), tchórze, jeże uszate oraz susły.
- Znaczne zagrożenie stanowi również tratowanie gniazd przez bydło, owce i kozy, zwłaszcza w okolicach osad ludzkich.
Badania przeprowadzone w Kazachstanie (2005–2012) wskazują, że ptaki gniazdujące bliżej wiosek miały wyższą przeżywalność, mimo większego ryzyka strat spowodowanych przez zwierzęta gospodarskie.
Zagrożenia
Czajka towarzyska zmaga się z wieloma zagrożeniami na różnych etapach swojego cyklu życiowego, zarówno na terenach lęgowych, jak i podczas migracji oraz zimowania. W ostatnich dekadach populacja tego gatunku znacząco zmalała, a główne przyczyny tego spadku są złożone i wieloczynnikowe.
Jednym z najpoważniejszych zagrożeń dla czajki towarzyskiej są nielegalne polowania na trasach migracyjnych oraz na zimowiskach. Dane z lat 2005–2012 wskazują, że niska przeżywalność dorosłych osobników, wynikająca z presji łowieckiej, jest kluczowym czynnikiem wpływającym na demografię gatunku.
W przeszłości kluczowym zagrożeniem było przekształcanie stepów w grunty uprawne, co prowadziło do utraty naturalnych terenów lęgowych. Po upadku ZSRR wiele pól uprawnych zostało jednak opuszczonych, co pozwoliło na częściową regenerację stepów. Jednocześnie stada zwierząt gospodarskich zaczęły koncentrować się wokół wiosek, co prowadzi do krótszej roślinności i zmiany struktury siedlisk.
Z kolei wzrost liczby pożarów stepowych, wynikający z ograniczonej kontroli, mógł przyczynić się do zwiększenia dostępnych siedlisk, co w niektórych regionach Kazachstanu mogło wpłynąć na wzrost liczebności czajki towarzyskiej w ostatnich latach.
Czajki często gniazdują w pobliżu wiosek, na obszarach intensywnie wypasanych. Tratowanie gniazd przez owce, kozy i bydło może być jednym z czynników wpływających na spadek liczebności. Ponadto niska przeżywalność jaj na obszarach o dużej koncentracji roślinożerców również przyczynia się do ograniczenia sukcesu lęgowego gatunku.
Wcześniej podejrzewano, że gawrony (Corvus frugilegus), których liczebność wzrosła wraz z zakładaniem pasówzadrzewień, mogą być istotnym drapieżnikiem czajki towarzyskiej. Jednak badania w Kazachstanie wskazują, że ich wpływ na populację jest prawdopodobnie niewielki.
Czajka towarzyska może również odczuwać skutki postępującego ocieplenia klimatu, jednak nie jest jasne, czy zmiany w warunkach klimatycznych są dla niej korzystne, czy szkodliwe.
Na terenach migracyjnych i zimowiskach czajka towarzyska jest zagrożona intensyfikacją rolnictwa, nadmiernym wypasem oraz degradacją siedlisk stepowych. Przykładem negatywnego wpływu działalności człowieka jest projekt nawadniający w Turcji, który rozprowadza wodę z tamy Atatürka na pola wokół Ceylanpinar. Zmiana charakteru siedlisk w tym regionie może prowadzić do dalszego ograniczenia miejsc odpoczynku i żerowania czajki towarzyskiej
Sytuacja w Polsce
W Polsce czajka towarzyska jest objęta ścisłą ochroną gatunkową. Ze względu na jej rzadkość, obserwacje tego ptaka stanowią wyjątkowe wydarzenie dla miłośników ornitologii. Ostatnie stwierdzenia miały miejsce w różnych regionach kraju, jednak nadal pozostaje ona niezwykle rzadkim gościem na naszych terenach.
Czajka towarzyska jest gatunkiem stepowym, który przystosował się do warunków półpustynnych i rolniczych. Jej populacja jest wrażliwa na zmiany środowiskowe, a presja ze strony drapieżników, wypasu zwierząt i degradacji siedlisk może ograniczać jej sukces rozrodczy. W związku z tym kluczowe dla ochrony tego gatunku jest zachowanie odpowiednich terenów lęgowych oraz monitorowanie wpływu działalności człowieka na jego populację.
Czajka towarzyska jest gatunkiem silnie zagrożonym, a jej populacja maleje głównie z powodu presji łowieckiej, degradacji siedlisk oraz zmian w użytkowaniu ziemi. Kluczowe dla ochrony gatunku są ograniczenie nielegalnych polowań, ochrona naturalnych stepów oraz monitorowanie wpływu zmian klimatycznych na populację tego wędrownego ptaka.

8. Trznadel złotawy. Trznadel żółtobrzuchy (Emberiza aureola)
Trznadel żółtobrzuchy Emberiza aureola został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2017 r. Emberiza aureola jest sklasyfikowana jako gatunek krytycznie zagrożony.
Trznadel złotawy jest gatunkiem wędrownym.. Zimuje w Azji Południowej i Południowo-Wschodniej, od środkowego i wschodniego Nepalu, Bangladeszu, północno-wschodnich Indii, po południowo-wschodnie Chiny (Guangdong, Tajwan) oraz północny Półwysep Malajski i Azję Południowo-Wschodnią
Gwałtowny spadek populacji
Trznadel złotawy (Emberiza aureola) niegdyś licznie występował na rozległych terenach północnej Palearktyki, od Finlandii, Białorusi i Ukrainy na zachodzie, przez Kazachstan, Chiny i Mongolię, aż po dalekowschodnią Rosję, Koreę i północną Japonię. Jednak w ostatnich dekadach jego populacja uległa dramatycznemu spadkowi, a gatunek niemal całkowicie zniknął z Finlandii, Białorusi, Ukrainy i dużej części Rosji (Kamp et al., 2015).
Jesienią ptaki te gromadzą się w Dolinie Jangcy w Chinach, gdzie przechodzą pierzenie, zanim wyruszą do zimowisk w Azji Południowej i Południowo-Wschodniej. Ich zimowy zasięg obejmuje wschodni Nepal, północno-wschodnie Indie, Bangladesz, Birmę, południowe Chiny, Kambodżę, Laos, Wietnam i Tajlandię.
Trznadel złotawy był niegdyś jednym z najliczniejszych ptaków lęgowych na Syberii, jednak od lat 90. XX wieku obserwuje się jego gwałtowny spadek liczebności.
- Finlandia – od 2009 r. brak stwierdzeń lęgowych.
- Kazachstan – zasięg lęgowy skurczył się o 300 km na północ, choć gatunek nadal występuje wzdłuż rzeki Irtysz w pobliżu Irtyjska (R. Ayé, 2013).
- Rosja – w latach 2000–2012 populacja zmniejszyła się o 95–99% w europejskiej części kraju (BirdLife International, 2015).
Utrata siedlisk i spadek liczebności w Rosji
Poważne spadki odnotowano w obwodach moskiewskim, nowogrodzkim, kostromskim, uljanowskim i bajkałowskim (Miszczenko, 2012). Drastyczne zmniejszenie populacji w regionie Tiumenia w 2011 r. sugeruje załamanie populacji w zachodniej Syberii. Jednak w regionach Amuru i Czabarowska sytuacja jest nieco lepsza – w Parku Muraviovka (6500 ha) w 2013 r. odnotowano 100–150 par lęgowych, choć populacja nadal maleje (Kamp et al., 2013).
Krytyczny spadek w Azji Wschodniej i Południowej
- Japonia (Hokkaido) i Mongolia – populacje są w szybkim zaniku.
- Chiny – gatunek nie występuje już w dawnych punktach migracyjnych, takich jak Beidaihe.
- Kambodża – liczebność drastycznie spadła od połowy lat 90.
- Nepal – od 1990 r. obserwuje się wyraźne zmniejszenie populacji.
- Bangladesz – na mokradłach Hail Haor gatunek zanika od lat 80.
Zmiana zasięgu i tempo wymierania
Szacuje się, że w latach 1980–2013 populacja zmniejszyła się o 84,3–94,7%, a jej zasięg przesunął się o 5000 km na wschód (Kamp et al., 2015). Wcześniej trznadel złotawy tworzył ogromne stada w punktach migracyjnych, ale obecnie liczebność w zimowiskach drastycznie maleje.
Krytyczny spadek w Europie
Populacja lęgowa trznadla złotawego w Europie w 2004 roku była szacowana na 20 000–100 000 par, co odpowiadało 60 000–300 000 osobników (BirdLife International, 2004). Europa, przynajmniej w przeszłości, stanowiła 25–49% światowego zasięgu gatunku. Jednak najnowsze dane wskazują, że populacja europejska liczy obecnie jedynie 120–600 dojrzałych osobników (BirdLife International, 2015).
Dostępne badania oraz obserwacje terenowe wskazują na bardzo szybki i rozległy spadek liczebności gatunku.
- Populacja europejska zmniejsza się o ponad 80% w ciągu 10,8 roku (trzech pokoleń) i o ponad 25% w ciągu jednego pokolenia (3,6 roku) (BirdLife International, 2015).
- W latach 1980–2013 liczebność trznadla złotawego spadła o 84,3–94,7%.
- Zakładając stałe tempo spadku, w ciągu trzech pokoleń (10,8 roku) populacja mogła zmniejszyć się o 45,4–61,8%, jednak tempo wymierania wzrosło szczególnie w ostatnich dekadach.
Ponowna analiza danych z lat 2002–2013 wykazała, że populacja spadła o 70–89% w ciągu 11 lat . Z miejsc, które posiadają pełne dane z tego okresu:
- W trzech lokalizacjach zanotowano 99–100% spadku populacji.
- W innych miejscach spadki wynosiły 84% (1999–2013) oraz około 50% w innych lokalizacjach.
Globalne tempo spadku
Obecnie przyjmuje się, że populacja zmniejszyła się o ponad 80% w latach 2002–2013, chociaż brak pełnych danych uniemożliwia dokładne oszacowanie.
- Jeśli spadki na wschód od jeziora Bajkał były bliższe 50%, ogólny spadek mógłby wynosić mniej niż 80%.
- Jeśli jednak na wschód od Bajkału spadki sięgały 80%, wówczas globalna populacja mogła zmniejszyć się nawet o ponad 90% w tym okresie (J. Kamp, 2017).
- Dlatego obecne szacunki wskazują, że tempo spadku w ciągu trzech pokoleń mieści się w przedziale 50–99%, przy czym ostrożnie zakłada się wyższy zakres.
Siedlisko i ekologia
Trznadel złotawy gniazduje na podmokłych łąkach z wysoką roślinnością i rozproszonymi krzewami, a także w zaroślach nadrzecznych i wtórnych.
- Zimuje w dużych stadach na terenach uprawnych, szczególnie na polach ryżowych i łąkach. Preferuje zarastające suche pola ryżowe do żerowania oraz trzcinowiska jako miejsca odpoczynku.
- Sezon lęgowy trwa od połowy czerwca do początku lipca.
- Samica buduje gniazdo – umieszcza je w zagłębieniu na ziemi pod kępami trawy lub w gęstej roślinności.
- Jaja (3–7, najczęściej 4–5) składane są w gnieździe wyścielonym suchą trawą, korzonkami i czasami włosiem.
- Dieta: W okresie lęgowym żywi się głównie bezkręgowcami, poza sezonem lęgowym – nasionami i innym materiałem roślinnym.
Sytuacja w Polsce
W Polsce trznadel złotawy jest niezwykle rzadkim gościem. Do 2003 roku odnotowano jedynie pięć przypadków jego pojawienia się w naszym kraju.Ze względu na wątpliwości co do naturalnego pochodzenia tych osobników, Komisja Faunistyczna zaliczyła te obserwacje do kategorii D, co oznacza, że ich naturalność jest niepewna. W związku z tym, trznadel złotawy nie jest uznawany za gatunek lęgowy w Polsce, a jego obecność na naszym terytorium jest incydentalna i sporadyczna.
Trznadel złotawy znajduje się na skraju wymarcia. Szacuje się, że w Europie liczebność spadła niemal do całkowitego wyginięcia, a globalnie stracił on ponad 80–90% swojej populacji w ciągu ostatnich dekad. Główne zagrożenia to utrata siedlisk lęgowych, intensyfikacja rolnictwa, polowania oraz handel ptakami w Azji. Ochrona gatunku wymaga międzynarodowej współpracy, ścisłej ochrony siedlisk oraz działań przeciwdziałających nielegalnemu odłowowi. jego populacja maleje w alarmującym tempie. Kluczowe dla ochrony tego gatunku są zabezpieczenie terenów lęgowych i zimowisk, monitoring populacji oraz ograniczenie nielegalnego odłowu ptaków.
RYBY
9. Allis Shad. Aloza Finta. Aloza. Śledź Rzeczny (Alosa alosa)
Gatunek Allis Shad Alosa alosa został ostatnio oceniony pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych IUCN w 2022 r. Alosa alosa jest sklasyfikowana jako gatunek krytycznie zagrożony. Aloza (Alosa alosa), znana również jako śledź rzeczny, to anadromiczna ryba z rodziny śledziowatych,
W Afryce Północnej. Gatunek Allis Shad Alosa alosa został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2007 r. Gatunek Alosa alosa znajduje się na liście gatunków regionalnie wymarłych.
Wygląd i morfologia
Alosa alosa, czyli aloza, to ryba o długości ciała sięgającej do 83 cm, choć zwykle mierzy 35–40 cm. Jej ciało jest bocznie spłaszczone, wysokie i pokryte cykloidalnymi łuskami – wzdłuż ciała znajduje się 70–80 łusek. Gatunek ten nie posiada linii nabocznej.
Na pierwszym łuku skrzelowym znajdują się bardzo liczne (90–130) cienkie wyrostki filtracyjne, których liczba zależy od wieku osobnika. Kil brzuszny jest dobrze rozwinięty, a jego łuski mają ostro zakończone krawędzie. Głowa pozbawiona jest łusek, a górna szczęka posiada charakterystyczne wcięcie w połowie długości. Oczy osłonięte są nieruchomymi, przezroczystymi powiekami pionowymi. Aloza posiada krótką płetwę grzbietową, ale brak u niej płetwy tłuszczowej.
Ubarwienie
- Grzbiet – niebieskozielony.
- Głowa – złotobrązowa.
- Boki i brzuch – złociste.
- Plamy – za pokrywą skrzelową występuje jedna duża czarna plama oraz 1–2 mniejsze, mniej wyraźne plamy, ułożone jedna za drugą.
Spadek populacji alozy
Gatunek ten od początku XX wieku doświadcza znaczącego globalnego spadku populacji i został wytępiony na dużej części swojego historycznego zasięgu.
Stan populacji w Europie
- Francja – Największe pozostałe subpopulacje, rozmnażające się w rzekach Dordogne, Garonne i Loara, od 2003 roku zmniejszyły się o co najmniej 80%. Główne przyczyny to nadmierne połowy w estuariach oraz możliwy wpływ efektu Allee na dynamikę reprodukcyjną. Istnieją jednak pojedyncze dowody na ograniczoną odbudowę populacji w Sekwanie.
- Niemcy i Szwajcaria – Gatunek praktycznie zniknął z Renu, którym dawniej migrował na odległość ponad 850 km do Bazylei.
- Półwysep Iberyjski – Od połowy XX wieku populacja zmniejszyła się o około 90%. Ostatnia stabilna subpopulacja ogranicza się do 80-kilometrowego odcinka dolnego biegu rzeki Minho (północna Portugalia i zachodnia Hiszpania).
- Maroko i śródziemnomorska Hiszpania – Aloza przestała się rozmnażać w tych regionach.
Sytuacja w Polsce
Aloza kiedyś występowała w polskich wodach. Obecnie jej populacja w Polsce jest praktycznie wymarła. Ostatnie odnotowane wystąpienie alozy miało miejsce w 1998 roku w rejonie Białej Góry. Obserwowane obecnie w polskich wodach osobniki parposza (Alosa fallax), blisko spokrewnionego gatunku, prawdopodobnie pochodzą z populacji rozmnażającej się w litewskiej części Zalewu Kurońskiego. W związku z tym, status populacji alozy w Polsce jest obecnie nieznany, a gatunek ten uznawany jest za niemal wymarły na terenie Europy
Malejące subpopulacje i trudności w monitoringu
Mniejsze subpopulacje w całym zasięgu gatunku również wykazują tendencję spadkową. Wiele z nich jest bardzo małych, a niektóre mogą utrzymywać się jedynie dzięki rekrutacji migrujących osobników z większych populacji.
Badania sugerują, że przepływ genów odbywa się głównie między sąsiadującymi subpopulacjami, co może ograniczać możliwości naturalnej odbudowy. Ilościowe określenie trendów populacyjnych jest jednak utrudnione przez brak historycznych danych, naturalne wahania liczebności oraz fakt, że aloza często nie jest odróżniana od podobnie wyglądającej alozy twardopłetwej (Alosa fallax) w raportach rybackich.
Siedlisko i ekologia
Allis Shad to ryba o wyjątkowych przystosowaniach: jest euryhaliczna (toleruje różne stężenia soli), anadromiczna (migracyjna – żyje głównie w morzu, ale na tarło wędruje do słodkowodnych rzek) oraz semelparyczna (rozmnaża się tylko raz, po czym większość osobników umiera).
Siedlisko:
- Występuje przede wszystkim w przybrzeżnych wodach i estuariach.
- Interesującym zjawiskiem jest pojawienie się populacji śródlądowej, którą można spotkać choćby w jednym portugalskim jeziorze sztucznym.
Żywienie:
- Na morzu ryba odżywia się głównie planktonem i jest przystosowana do życia w pelagicznych (otwartych) wodach, nawet na głębokościach dochodzących do 300 metrów.
- W słodkiej wodzie, podczas gdy dorosłe osobniki nie podejmują aktywnego żerowania, młode ryby polują na larwy owadów.
Migracja i tarło:
- Dorosłe ryby migrują do głównych nurtów i dużych dopływów słodkowodnych, zazwyczaj w pobliżu ujść rzek, aby odbyć tarło.
- Samce rozpoczynają migrację w wieku 3–9 lat, a samice zazwyczaj 1–3 lata później – średnia długość pokolenia wynosi około 7 lat.
- Proces migracyjny zaczyna się pod koniec lutego, gdy ryby zbliżają się do linii brzegowej. Wchodzą one do rzek, gdy temperatura osiąga 10–12°C – u populacji południowych już w lutym, a u północnych dopiero w kwietniu. Samce często ruszają w drogę nieco wcześniej niż samice.
Warunki tarła:
- Tarło odbywa się w płytkich, szybko płynących odcinkach rzek, na dnie pokrytym otoczakami, żwirem lub kamieniami.
- Rozpoczyna się przy temperaturze 15°C, jednak najbardziej sprzyjający zakres wynosi 22–24°C.
- W trakcie rozrodu dorosłe ryby tworzą liczne, często hałaśliwe ławice przy powierzchni wody, szczególnie w nocy. Jaja unoszone przez prąd zatrzymują się ostatecznie w dnie.
Rozwój młodych:
- Po tarle młode ryby przemieszczają się w dół rzek, docierając do ujść i estuariów, gdzie spędzają kilka miesięcy – najczęściej latem i jesienią – zanim wyruszą w migrację do morza.
Powrót do miejsc tarła i hybrydyzacja:
- Istnieje przekonanie, że dojrzałe osobniki powracają do miejsc, w których się urodziły, co potwierdzają badania genetyczne ujawniające istotne różnice między populacjami.
- W niektórych rejonach obserwuje się również naturalną hybrydyzację Allis Shad z pokrewnym gatunkiem Alosa fallax. Niektóre badania sugerują, że zjawisko to nasiliło się w ostatnim czasie.
Zagrożenia
Populacja Allis Shad zmaga się z szeregiem zagrożeń, które znacząco wpływają na jej liczebność i zdolność do rozmnażania. Główne czynniki to:
Nadmierne połowy i zanieczyszczenie: Intensywne połowy, zanieczyszczenie wód oraz zmienione obciążenie osadowe powodują znaczący spadek liczebności tego gatunku.
Budowa tam i barier hydrotechnicznych: Budowa tam oraz innych przeszkód ogranicza dostęp do tradycyjnych miejsc tarła. Allis Shad nie jest w stanie pokonać przeszkód wyższych niż około 1 metr, co skutkuje blokowaniem ich migracji w górę rzeki.
Wydobywanie żwiru: Intensywna eksploatacja żwiru z koryt rzek zmniejsza zarówno zasięg, jak i jakość siedlisk tarłowych, co dodatkowo pogarsza warunki do rozmnażania.
Introgresja genetyczna: Hybrydyzacja z pokrewnym gatunkiem, shad twaite (Alosa fallax), stanowi kolejne zagrożenie. W naturalnych warunkach oba gatunki są reprodukcyjnie izolowane – Allis Shad odbywa tarło znacznie wyżej w górę rzeki niż shad twaite. Jednakże, gdy migracja jest blokowana przez sztuczne bariery, zmuszane są do wspólnego korzystania z ograniczonych tarlisk, co skutkuje zwiększonym występowaniem potomstwa hybrydowego i zagrożeniem czystości genetycznej subpopulacji.
Zmiany klimatyczne: Wpływ zmian temperatury wody na skutek zmian klimatycznych może w przyszłości spowodować, że niektóre systemy rzeczne na południu zasięgu staną się nieodpowiednie do tarła. Jednocześnie, korzystniejsze warunki mogą pojawić się na północy, co wpłynie na przesunięcie obszarów rozmnażania.
Użytkowanie
Dawniej gatunek ten był intensywnie eksploatowany jako ryba spożywcza na całym swoim zasięgu, jednak obecnie większość połowów znacząco spadła. Komercyjnie połowy prowadzone są głównie we Francji, Portugalii oraz Galicji (Hiszpania), gdzie ryba ta pozostaje jednym z najcenniejszych ekonomicznie gatunków w rybołówstwie śródlądowym. W pozostałych krajach jej zasięgu stanowi regularny składnik przyłowu w rybołówstwie morskim i estuarialnym, zwłaszcza podczas corocznej migracji tarłowej. Dodatkowo, niewielkie ilości są pozyskiwane przy użyciu włoków i okrężnic na obszarze środkowo-wschodniego Atlantyku. Dawniej ceniona ze względu na walory smakowe mięsa, niemniej ze względu na zdziesiątkowanie populacji obecnie nie ma żadnego znaczenia gospodarczego.
Przyszłość Allis Shad stoi pod znakiem zapytania, a jej przetrwanie wymaga pilnych działań ochronnych. Gatunek ten znajduje się w krytycznej sytuacji, a wiele jego subpopulacji jest na skraju wyginięcia. Główne zagrożenia to nadmierne połowy, degradacja siedlisk rozrodczych oraz ograniczona zdolność do odbudowy populacji. Skuteczna ochrona wymaga lepszego monitoringu, rygorystycznych regulacji połowowych oraz działań na rzecz przywrócenia tras migracyjnych.

10. Węgorz europejski. European eel (Anguilla Anguilla)
Węgorz europejski Anguilla anguilla został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2018 r. Anguilla anguilla jest wymieniona jako gatunek krytycznie zagrożony.
W Afryce Północnej gatunek jest uznany za zagrożony.
Rozprzestrzenienie i ekologia
- Rozprzestrzenienie: Węgorz europejski występuje w większości wód śródlądowych Europy, od Przylądka Północnego w północnej Norwegii, na południe wzdłuż wybrzeża Europy, wszystkich wybrzeży Morza Śródziemnego i wybrzeża Afryki Północnej. Rzadko wpływa do Morza Białego i Morza Barentsa, ale odnotowano ją na wschód do rzeki Peczora w północno-zachodniej Rosji. Gatunek ten występuje również w regionie Morza Czarnego, skąd migruje na wschód do dorzecza Kubania i sporadycznie dociera do dorzecza Wołgi przez kanały. Występuje również w północnej Skandynawii i wschodniej Europie.
- Populacje morskie: Stada węgorzy europejskich obejmują mieszkańców wód słodkich, mieszkańców wód słonych i migrantów międzysiedliskowych. Kontynentalny zasięg obejmuje około 90 000 km² w Europie i części Afryki Północnej, a uwzględniając zasięg morski, obszar ten jest znacznie większy.
- Wprowadzenie do Azji: Przed zaprzestaniem importu i eksportu do i z UE w 2010 r., węgorze europejskie były eksportowane do Azji na potrzeby akwakultury. Część osobników mogła uciec lub zostać uwolniona do wód azjatyckich, ale populacje te nie przyczyniają się do tarła.
- Tarło: Węgorz europejski odbywa tarło w Morzu Sargassowym w środkowo-zachodniej części Atlantyku między późną zimą a wczesną wiosną. Po wykluciu się larwy leptocefala migrują z powrotem przez Atlantyk, aby rozpocząć kontynentalną fazę swojego cyklu życiowego.
Określenie zmian w populacji węgorza europejskiego (*Anguilla anguilla*) jest trudne ze względu na ograniczone dane i słabe zrozumienie związku między rekrutacją, węgorzami w wodach kontynentalnych i ucieczką. Istnieje duże opóźnienie czasowe (dziesiątki lat) między rekrutacją węgorzy szklistych do wód słodkich i słonawych a późniejszą ucieczką węgorzy srebrzystych. Ponadto, ponieważ *Anguilla anguilla* jest gatunkiem panmiktycznym, ucieczka z jednego obszaru nie przekłada się bezpośrednio na powrót rekrutacji larw w tej samej lokalizacji. Praktycznie nic nie wiadomo o dynamice populacji fazy oceanicznej tego gatunku.
Rekrutacja węgorzy szklanych i żółtych
Dane dotyczące rekrutacji węgorzy szklanych i młodych osobników pochodzą z analizy ICES. Dane te obejmują Norwegię, Szwecję, Niemcy, Danię, Holandię, Belgię, Wielką Brytanię, Irlandię, Francję, Hiszpanię, Portugalię i Włochy. Od początku lat 80. XX wieku obserwowano stały spadek rekrutacji węgorzy szklanych. Indeks rekrutacji ICES spadł do najniższego poziomu historycznego w 2012 r.: mniej niż 1% dla Morza Północnego i 5% w innych miejscach w porównaniu do rekrutacji z lat 1960–1979. W 2019 r. tymczasowy indeks rekrutacji wynosił 1,4% poziomu odniesienia z lat 1960–1979 dla Morza Północnego i 6,0% dla innych miejsc.
Węgorz żółty
Dane dotyczące węgorza żółtego obejmują Skagerrak (południowa Norwegia), Den Burg (Holandia) i East Anglian River Basin District (Wielka Brytania). Analizy danych sugerują spadki liczebności węgorza żółtego, które nie były tak poważne jak te dotyczące rekrutacji. W East Anglian RBD średni spadek wynosił od 50% do 80% w okresie trzech pokoleń (39 lat). Podobne spadki odnotowano w Skagerrak i Den Burg.
Węgorz srebrzysty
Dane dotyczące węgorza srebrzystego pochodzą z Francji, Norwegii i Irlandii. Spadek liczebności węgorza srebrzystego nie jest tak wyraźny jak w przypadku wskaźników rekrutacji, ale wskazuje na średni spadek o 50% do 80% w okresie trzech pokoleń (39 lat).
Oceny regionalne i krajowe
Anguilla anguilla została uwzględniona w szeregu regionalnych i krajowych ocen Czerwonej Listy w Europie w ciągu ostatnich 10 lat. Węgorz europejski został oceniony jako krytycznie zagrożony w całej Europie dla obszaru Morza Bałtyckiego, a także w Szwecji, Danii, Francji, Irlandii i północnej Belgii. W Norwegii status jest obecnie narażony. W Afryce Północnej węgorz europejski jest zagrożony ze względu na spadek rekrutacji o 50% w ciągu ostatnich 10 lat.
Sytuacja w Polsce
W Polsce węgorz europejski jest cenioną rybą konsumpcyjną, często spotykaną w menu smażalni ryb, zwłaszcza w formie wędzonej.W celu ochrony populacji węgorza europejskiego, Polska opracowała i wdrożyła “Plan gospodarowania zasobami węgorza w Polsce”, który został zaakceptowany przez Komisję Parlamentu Europejskiego 6 stycznia 2010 roku.
Plan ten wprowadził zmiany w przepisach dotyczących gospodarki rybackiej, takie jak okresy ochronne i nowe wymiary ochronne na obszarze polskich wód terytorialnych Morza Bałtyckiego. Pomimo tych działań, populacja węgorza europejskiego w Polsce pozostaje pod presją, głównie z powodu nadmiernych połowów, zanieczyszczenia wód oraz utraty siedlisk. Dlatego kontynuacja działań ochronnych i zrównoważone zarządzanie zasobami tego gatunku są kluczowe dla jego przetrwania w polskich wodach.
Siedlisko i ekologia
Cykl życia węgorza europejskiego obejmuje kilka etapów, z których każdy ma swoją terminologię:
- Etap Leptocefali: Ten larwalny etap ma kształt liścia i występuje w środowiskach morskich.
- Etap Szklistego Węgorza: Gdy leptocefale docierają do wód kontynentalnych, przekształcają się w szkliste węgorze.
- Etap Żółtego Węgorza: Szkliste węgorze rozwijają pigmentację, przechodząc w fazę wzrostu żółtego węgorza.
- Etap Srebrzystego Węgorza: Ostatnim etapem jest migrujący morsko-srebrzysty węgorz, charakteryzujący się srebrzystym cieniowaniem i dużymi oczami.
Siedlisko
Gatunek ten występuje w różnorodnych środowiskach, od małych strumieni po duże rzeki i jeziora, a także w estuariach, lagunach i wodach przybrzeżnych (ICES 2015). Zajmuje również otwarte obszary oceaniczne podczas migracji, choć rzadko jest tam obserwowany. W naturalnych warunkach występuje tylko w zbiornikach wodnych połączonych z morzem; gdzie indziej jest zarybiany.
Ekologia
Węgorz europejski jest fakultatywnie katadromiczny, żyjąc w wodach słodkich, słonawych i przybrzeżnych, ale migrując do pelagicznych wód morskich w celu rozrodu. Chociaż kontynentalna historia życia węgorza jest częściowo znana, faza morska pozostaje w dużej mierze tajemnicą. Migracje węgorza europejskiego są najdłuższymi i najbardziej złożonymi oceanograficznie wśród gatunków Anguillid.
Nie ma dokładnych danych na temat konkretnych miejsc tarła, jednak istnieje hipoteza, że tarło odbywa się w eliptycznej strefie o szerokości około 2000 km w Morzu Sargassowym, w środkowo-zachodniej części Atlantyku (od 70°W na wschód do 50°W). Uważa się, że tarło ma miejsce między późną zimą a wczesną wiosną. Dorosłe węgorze przypuszczalnie giną po tarle. Oceaniczna migracja leptocefali trwa średnio około dwóch lat, zanim dotrą do szelfu kontynentalnego (B. Mechanizmy, dzięki którym leptocefale docierają do wybrzeży Europy i Afryki Północnej, nie są dobrze poznane.
Rekrutacja odbywa się wzdłuż gradientu z południa na północ ( proces, w którym młode węgorze, zwane też narybkiem, migrują z obszarów ich tarła w morzach (na przykład Morza Sargassowego ) do wód słodkich, gdzie dorastają). przez około cztery do pięciu miesięcy, zaczynając we wrześniu na północnym zachodzie i stopniowo później w Kanale La Manche i Morzu Północnym. Rekrutacja w Morzu Śródziemnym jest bardziej złożona, z większością węgorzy wchodzących między grudniem a marcem, szczyt przypada na styczeń. Niektóre obszary mają rekrutację przez cały rok.
Szkliste węgorze wchodzą do wód słodkich jako osobniki niezróżnicowane płciowo. Rozwój narządów płciowych jest ściśle związany z rozmiarem ciała i fazą żółknięcia cyklu życiowego. Determinacja płci jest głównie napędzana przez czynniki środowiskowe, a zależność od zagęszczenia powoduje, że przy dużym zagęszczeniu powstaje więcej samców. Samce węgorzy europejskich początkowo rosną szybciej niż samice, ale samice osiągają większy wiek i rozmiar przy dojrzewaniu płciowym.
Średnia długość znacznie rośnie wraz z szerokością geograficzną u samic, ale nie u samców, podczas gdy wiek znacznie wzrasta u obu (D, nieopublikowane dane). Samce dojrzewają przy najmniejszym rozmiarze pozwalającym na udaną migrację tarłową, zwykle <450 mm (Davey & Jellyman, 2005). Samice przyjmują bardziej elastyczną strategię maksymalizacji rozmiaru przed migracją, wymieniając śmiertelność przed reprodukcyjną na płodność. Znaczna zmienność geograficzna występuje w średniej długości metamorfozy samców i samic węgorzy europejskich opisali ekstremalne rozmiary na każdym etapie życia węgorza, opierając się na danych długoterminowych z Holandii, a artykuł omówił również sytuację międzynarodową (rozmiary (cm): min.–maks., szkliste węgorze: 5,4–9,2, żółte węgorze: 6,9–133,0, srebrzyste węgorze (samce): 21,2–44,4, srebrzyste węgorze (samice): 26,4–101,0). Zależność od zagęszczenia często prowadzi do przekrzywionych proporcji płci w poszczególnych lokalizacjach oraz geograficznych odchyleń związanych z szerokością geograficzną.
Wzrost węgorza zwiększa się wraz z temperaturą, co udokumentowano w akwakulturze a tempo wzrostu jest generalnie szybsze w wodzie słonej niż słodkiej Węgorze urodzone w wodach słonych mają zwykle wyższą zawartość tłuszczu i mniejsze ilości pasożyta pęcherza pławnego Anguillicola crassus, co może zwiększać ich sukces tarłowy. Obciążenie toksycznymi związkami, wpływające na migrację i sukces reprodukcyjny, jest zróżnicowane regionalnie i zależy od lokalnego zanieczyszczenia.
W zależności od rozmiaru, węgorze żywią się różnymi organizmami, w tym rybami, obunogami i skorupiakami dziesięcionogami. W słonych siedliskach o mulistym dnie węgorze żerują na małżach, krewetkach, małych rybach i wieloszczetach. Skłonność do drapieżnictwa rośnie z długością węgorza: węgorze >40 cm mogą zjadać większą zdobycz, taką jak ryby lub skorupiaki.
Zaobserwowali, że niska biomasa ochotkowatych ( Ochotkowate Chironomidae – rodzina muchówek. Są to małe i bardzo małe owady podobne do komarów, o wydłużonych przednich nogach i wydatnych czułkach. Są jedną z najliczniejszych w gatunki rodzin w świecie zwierząt – na świecie opisano ponad 10 000 gatunków, w Polsce około 500.) prowadzi do przestawienia się węgorzy na żerowanie na rybach.
ROŚLINY

11. Fruchtbares Schlafmoos, Rokiet płodny (Hypnum fertile). Mszaki
Gatunek Hypnum fertile, gatunek o nazwie Fruchtbares Schlafmoos, został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2017 r. Gatunek Hypnum fertile został uznany za gatunek krytycznie zagrożony
Informacje identyfikacyjne
Hypnum fertile to wieloletni mech pleurokarpowy, który tworzy płaskie, błyszczące kępy o zielonym lub żółtozielonym zabarwieniu. Określenie pleurokarpowy oznacza, że struktury reprodukcyjne (sporofity) powstają na bocznych częściach rośliny, co sprawia, że mech rośnie rozłożysto, tworząc rozległe kępy lub maty.
Łodygi Hypnum fertile osiągają do 10 cm długości, są niemal pierzasto rozgałęzione i mają pomarańczowobrązowy kolor. Układają się płasko na podłożu i są mocno przytwierdzone przez wiązki ryzoidalne – czyli skupiska cienkich, korzeniopodobnych struktur, które służą zarówno do przytwierdzania mchu do podłoża, jak i do absorpcji wody oraz składników odżywczych.
Liście łodygowe mają 1,5–2 mm długości, są jajowato-lancetowate, zakrzywione w jednym kierunku, wklęsłe i posiadają drobne ząbki w górnej, zwężonej części. Liście gałęziste są mniejsze, z szerokim czubkiem i ząbkowane w górnej połowie, z podwójnym, cienkim i krótkim nerwem.
Sporofity mają 2–2,2 mm długości, są pochylone i osadzone na długiej łodydze (seta) o długości 13–35 mm, której barwa zmienia się od czerwonego do żółtoczerwonego. Gatunek jest obupłciowy, co oznacza, że posiada zarówno męskie, jak i żeńskie struktury rozrodcze.
Zakres występowania
Jest to rzadki gatunek środkowoeuropejski, który dawniej był taksonomicznie włączany do pokrewnego gatunku z Ameryki Północnej i Azji o suboceanicznym, umiarkowanym i górskim zasięgu. Obecnie uznawany jest jednak za odrębny, endemiczny gatunek Europy.
Jego całkowity zasięg występowania (EOO) szacuje się na ponad 1,4 miliona km², co znacznie przekracza progi dla uznania go za gatunek zagrożony. Jednak rzeczywisty obszar zajmowany (AOO) jest znacznie mniejszy i wynosi około 180 km², z czego jedynie 120 km² znajduje się w krajach Unii Europejskiej.
Zasięg geograficzny
Gatunek ten był często błędnie identyfikowany. W Austrii jest wyjątkowo rzadki i występuje głównie na martwym drewnie. Dwa zapisane przypadki z Bułgarii pochodzą z odległej przeszłości, a większość europejskich danych pochodzi z Niemiec i Austrii – nowszych obserwacji jest znacznie mniej. Jedyny niedawny zapis pochodzi z Estonii (2016). W Polsce występowanie tego gatunku również jest sporadyczne, a potwierdzone zapisy są nieliczne, co podkreśla jego rzadkość.
Trend populacyjny wskazuje na stopniowy spadek. Choć populacja nie jest silnie rozdrobniona, poszczególne subpopulacje są bardzo małe – średnio występuje w nich od 1 do 2 ekwiwalentów osobników (jeden ekwiwalent oznacza jednego dojrzałego osobnika, czyli „kloc”, na którym rośnie gatunek). Szacuje się, że ogólna liczebność wynosi od 50 do 250 ekwiwalentów zarówno w Europie, jak i w ramach UE 28, przy mniej niż 50 ekwiwalentach na pojedynczą subpopulację.
Sytuacja w Polsce
Hypnum fertile, znany również jako rokiet płodny, to gatunek mchu z rodziny rokietowatych (Hypnaceae). W Polsce jego występowanie jest rzadkie i ograniczone do nielicznych stanowisk.
W polskiej części Bieszczadów Zachodnich stwierdzono obecność 89 taksonów mchów objętych ochroną prawną, w tym 13 gatunków podlegających ścisłej ochronie i 76 objętych ochroną częściową. Jednak w dostępnych źródłach nie ma jednoznacznych informacji na temat aktualnego statusu ochrony Hypnum fertile w Polsce.
Warto również wspomnieć, że Hypnum fertile został odnaleziony w rejonie Moczarnego przez badacza Lisowskiego w latach 50. XX wieku. Od tego czasu brak jest doniesień o jego ponownym występowaniu w tym miejscu, co może sugerować zanik populacji na tym stanowisku.
Ze względu na rzadkość występowania i potencjalne zagrożenia dla tego gatunku, istotne jest prowadzenie dalszych badań terenowych w celu aktualizacji danych na temat jego rozmieszczenia i stanu populacji w Polsce.
Zagrożenia
Gatunek ten może być zagrożony zarówno przez konwencjonalne metody leśnictwa, jak i nowoczesne praktyki zarządzania lasami. Mimo że występuje na obszarach chronionych, które zapewniają mu pewną ochronę, w Europie obserwuje się stały spadek dostępnych siedlisk. Konieczne są dalsze badania nad przyczynami tego spadku, a także wdrożenie działań na rzecz ochrony siedlisk oraz strategii ex-situ, aby zabezpieczyć przyszłość tego europejskiego gatunku endemicznego.

12. Jesion pensylwański. Jesion omszony. Zielony Jesion. Green Ash (Fraxinus pennsylvanica)
Gatunek Fraxinus pennsylvanica został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2017 r. Gatunek Fraxinus pennsylvanica jest wymieniony jako gatunek krytycznie zagrożony
opis
Jesion pensylwański to średniej wielkości drzewo liściaste, osiągające 12–25 m wysokości (rzadko do 45 m) i średnicę pnia do 60 cm. Młode drzewa mają gładką, szarą korę, która z wiekiem staje się gruba i spękana. Zimowe pąki są czerwonobrązowe i aksamitne.
Liście są nieparzystopierzaste, ułożone naprzeciwlegle, o długości 15–30 cm, składają się z 7–9 (rzadziej 5 lub 11) ząbkowanych listków o długości 5–15 cm. Jesienią przebarwiają się na złocistożółty kolor.
Kwiaty pojawiają się wiosną wraz z liśćmi, zebrane w zwarte wiechy, są drobne, bez płatków i wiatropylne. Owocem jest skrzydlak o długości 2,5–7,5 cm, zawierający pojedyncze nasiono.
Drzewo występuje w dwóch odmianach: Fraxinus pennsylvanica var. pennsylvanica (jesion czerwony) i Fraxinus pennsylvanica var. lanceolata (jesion zielony), jednak różnice między nimi są nieznaczne i nie są już uznawane przez większość botaników. Gatunek jest dwupienny – osobniki męskie i żeńskie występują oddzielnie.
Zasięg występowania
Jesion pensylwański (Fraxinus pennsylvanica) jest najpowszechniej występującym gatunkiem jesionu w Ameryce Północnej. Jego zasięg rozciąga się od wyspy Cape Breton w Kanadzie po Teksas, a na wschodzie obejmuje Nową Szkocję i północną Florydę. Jest odporny na mróz w strefach klimatycznych 3–9.
Gatunek został także wprowadzony do kilku krajów europejskich. Jego obszar występowania (EOO) jest bardzo rozległy – wynosi co najmniej 6 000 000 km², znacznie przekraczając progi dla kryterium B.
Istnieją rozbieżności co do obecności tego gatunku w Meksyku. The World Checklist of Selected Plants wskazuje, że występuje on na tym obszarze, natomiast inne źródła, takie jak NatureServe i USDA, temu zaprzeczają. W niniejszej ocenie uwzględniono dane z GBIF, co rozszerzyło EOO, jednak nie wpłynęło to na ogólną ocenę, ponieważ populacje meksykańskie stanowią jedynie niewielką część całkowitej populacji gatunku.
Jesion prowansalski w Polsce
Jesion pensylwański (Fraxinus pennsylvanica) został wprowadzony do Polski jako gatunek obcy i jest uprawiany głównie w parkach, alejach oraz na terenach zieleni miejskiej. Ze względu na swoją odporność na mróz i stosunkowo szybki wzrost, był sadzony jako drzewo ozdobne i zadrzewieniowe.
W niektórych regionach Polski gatunek ten zaczął się rozprzestrzeniać poza teren uprawy, pojawiając się na terenach ruderalnych oraz wzdłuż cieków wodnych. Nie osiągnął jednak dużej liczebności i nie jest uznawany za gatunek inwazyjny na szeroką skalę.
W porównaniu do rodzimego jesionu wyniosłego (Fraxinus excelsior), jesion pensylwański jest mniej podatny na ataki patogenów, takich jak Hymenoscyphus fraxineus – grzyb odpowiedzialny za groźną chorobę jesionów, znaną jako zamieranie jesionu. Mimo to jego rola w polskich ekosystemach pozostaje ograniczona, a jego występowanie koncentruje się głównie w nasadzeniach.
Populacja w szczegółach
Jesion pensylwański (Fraxinus pennsylvanica) jest szeroko rozpowszechnionym gatunkiem w Stanach Zjednoczonych, gdzie rosną miliardy osobników. Jednak jego populacja gwałtownie maleje z powodu inwazyjnego szmaragdowego kornika jesionowego (Agrilus planipennis), który został przypadkowo wprowadzony z Azji w latach 90.
Szkodnik ten infekuje zarówno zdrowe, jak i osłabione drzewa, powodując śmiertelność przekraczającą 99% w ciągu sześciu lat od zakażenia. Atakuje nawet młode drzewa o niewielkiej średnicy, zanim osiągną dojrzałość. Próby regeneracji przez odrosty korzeniowe są krótkotrwałe, a nasiona w leśnym banku nasion pozostają żywotne jedynie przez kilka lat.
Kornik nadal aktywnie rozprzestrzenia się na terenie Ameryki Północnej, a jego populacja utrzymuje się nawet wiele lat po masowym wymieraniu jesionów. Nie istnieją skuteczne metody zwalczania ani ograniczania jego wpływu, co prowadzi do prognozy, że w ciągu najbliższych 100 lat populacja F. pennsylvanica zmniejszy się o co najmniej 80%.
Habitat i ekologia w szczegółach
Jesion zielony (Fraxinus pennsylvanica) rośnie głównie na wilgotnych terenach nizinnych i przybrzeżnych, często na bagnach, preferując żyzne, dobrze zdrenowane gleby. Jest gatunkiem wyjątkowo przystosowawczym, tolerującym szeroki zakres temperatur i opadów.
Jest wskaźnikiem typu lasu Sugarberry-American Elm-Green Ash i często występuje z takimi gatunkami jak klony (Acer negundo, A. rubrum), hikora pekanowa (Carya illinoensis), topole (Populus deltoides, P. tremuloides), wierzba czarna (Salix nigra) i inne. Osiąga do 21 m wysokości, jest drzewem dwupiennym, wiatropylnym, kwitnącym od marca do maja. Jego owoce – jednonasienne samary – są rozsiewane przez wiatr i wodę.
W USA jesion zielony, wraz z jesionem białym (F. americana) i czarnym (F. nigra), stanowi około 14% wszystkich drzewiastych łodyg o średnicy powyżej 1 cm. Jest szczególnie istotnym elementem lasów środkowego zachodu i rejonu Wielkich Jezior, gdzie może stanowić nawet 25% biomasy leśnej. Jego nasiona są cennym źródłem pożywienia dla zwierząt.
Zagrożenia
Najpoważniejszym zagrożeniem dla Fraxinus pennsylvanica jest szmaragdowy kornik jesionowy (Agrilus planipennis), inwazyjny szkodnik pochodzący z Azji. Został odkryty w 2002 roku w Detroit, a jego inwazja prawdopodobnie rozpoczęła się już w latach 90. XX wieku wraz z importem zainfekowanego drewna. Obecnie szkodnik rozprzestrzenił się na 30 stanów USA i dwie kanadyjskie prowincje, obejmując większość naturalnego zasięgu jesionu zielonego.
Larwy kornika żerują w tkance łykowej drzew, przerywając transport wody i substancji odżywczych, co prowadzi do niemal 100% śmiertelności drzew w ciągu sześciu lat. Atakuje zarówno dorosłe drzewa, jak i młode sadzonki, uniemożliwiając naturalną regenerację populacji. Nasiona jesionu pozostają żywotne maksymalnie przez 7–8 lat, co dodatkowo ogranicza możliwości odrodzenia się gatunku.
Kornik może przetrwać na innych gatunkach jesionów oraz drzewach z rodziny Oleaceae, takich jak Chionanthus virginicus. Istnieją obawy, że zmiany klimatyczne umożliwią jego dalszą ekspansję na północ, a dotychczasowe modele rozprzestrzeniania się szkodnika są niejednoznaczne. W związku z brakiem skutecznych metod kontroli i brakiem dowodów na naturalne ograniczenie populacji kornika, należy uznać go za główne zagrożenie dla przetrwania Fraxinus pennsylvanica w Ameryce Północnej.
Jesion zielony (Fraxinus pennsylvanica) nie jest objęty ochroną prawną w Polsce, ponieważ nie jest rodzimym gatunkiem – został introdukowany głównie jako drzewo ozdobne.
- Patogeny grzybowe – W Europie, w tym w Polsce, największym zagrożeniem dla jesionów (głównie Fraxinus excelsior, ale także innych gatunków) jest zamieranie jesionu wywołane przez grzyb Hymenoscyphus fraxineus. Choroba prowadzi do obumierania liści, pędów i całych drzew.
- Zmiany klimatyczne – Coraz częstsze susze i ekstremalne zjawiska pogodowe mogą osłabiać jesiony, czyniąc je bardziej podatnymi na choroby i szkodniki.
- Szmaragdowy kornik jesionowy (EAB) – Choć w Europie Agrilus planipennis jeszcze nie występuje na dużą skalę, istnieje realne ryzyko, że może się rozprzestrzenić. Gatunek ten został już wykryty w europejskiej części Rosji, a jego dalsza ekspansja mogłaby zagrozić populacjom jesionu również w Polsce.
Natomiast rodzimy jesion wyniosły (Fraxinus excelsior) jest gatunkiem zagrożonym w Polsce głównie z powodu choroby zamierania jesionu (powodowanej przez grzyba Hymenoscyphus fraxineus). W związku z tym w niektórych rejonach podejmowane są działania ochronne, np. w parkach narodowych czy rezerwatach.
Obecnie w Polsce nie odnotowano inwazji szmaragdowego kornika jesionowego (Agrilus planipennis), który zagraża jesionom w Ameryce Północnej i części Europy. Jednak istnieją obawy, że w przyszłości może on dotrzeć do Polski i stanowić zagrożenie także dla rodzimych gatunków jesion
Wykorzystanie
Drewno Fraxinus pennsylvanica jest mocne, trwałe i odporne na wstrząsy, co czyni je cennym surowcem do produkcji uchwytów narzędzi, kijów baseballowych i innych specjalistycznych wyrobów. Dzięki swojej estetyce i funkcji dawania cienia jesion zielony stał się popularnym drzewem ozdobnym, szeroko sadzonym w parkach oraz wzdłuż ulic w miastach i na przedmieściach.
Jednak inwazja szmaragdowego kornika jesionowego doprowadziła do masowego zamierania drzew, co zmusza gminy w USA i Kanadzie do wydawania miliardów dolarów na ich usuwanie.
W przemyśle drzewnym jego drewno nie jest tak powszechnie wykorzystywane w Polsce jak drewno jesionu wyniosłego, ale jest cenione za trwałość i odporność na wstrząsy. Może być stosowane do produkcji narzędzi, mebli czy elementów sportowych, podobnie jak inne gatunki jesionu.
Podsumowanie:
Krytycznie zagrożone gatunki (CR) w Polsce i Europie – podsumowanie
Ssaki:
- Chomik europejski (Cricetus cricetus) – w Polsce objęty ścisłą ochroną gatunkową, populacja maleje z powodu intensyfikacji rolnictwa i urbanizacji.
- Norka europejska (Mustela lutreola) – uznawana za wymarłą w Polsce, jej miejsce zajęła inwazyjna norka amerykańska.
- Suseł perełkowany (Spermophilus suslicus) – w Polsce jego liczebność drastycznie spadła, objęty ochroną, prowadzone są programy reintrodukcji.
Ptaki:
- Burzyk balearski (Puffinus mauretanicus) – nie występuje w Polsce, zagrożony przez zmiany klimatyczne i drapieżniki na wyspach lęgowych.
- Czajka towarzyska (Vanellus gregarius) – rzadki migrant, nie gniazduje w Polsce, zagrożony przez utratę siedlisk lęgowych.
- Kulik cienkodzioby (Numenius tenuirostris) – prawdopodobnie wymarły, dawniej notowany w Polsce podczas migracji.
- Orzeł stepowy. Steppe Eagle (Aquila nipalensis) – w Polsce jest gatunkiem skrajnie rzadkim i pojawia się sporadycznie,
- Trznadel złotawy (Emberiza aureola) – dawniej notowany w Polsce jako bardzo rzadki gość, obecnie na skraju wymarcia w Europie.
Ryby:
- Aloza (Alosa alosa) – w Polsce uznawana za gatunek wymarły, dawniej występowała w Wiśle i Odrze.
- Węgorz europejski (Anguilla anguilla) – w Polsce występuje, lecz jego populacja drastycznie spada; objęty ochroną częściową, obowiązują ograniczenia połowowe.
Rośliny:
- Hypnum fertile – rzadki mszak, w Polsce brak potwierdzonych stanowisk.
- Jesion pensylwański (Fraxinus pennsylvanica) – introdukowany w Polsce, nie jest objęty ochroną, ale zagrożony przez szmaragdowego kornika jesionowego.
Większość tych gatunków wymaga pilnych działań ochronnych w Polsce i Europie, aby zapobiec ich całkowitemu wyginięciu.

źródła:
- BirdLife International. (2017). Emberiza aureola. Czerwona Księga Gatunków Zagrożonych IUCN 2017: e.T22720966A119335690. https://doi.org/10.2305/IUCN.UK.2017-3.RLTS.T22720966A119335690.en
- BirdLife International. (2018). Numenius tenuirostris. The IUCN Red List of Threatened Species 2018: e.T22693185A131111201. https://doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22693185A131111201.en
- BirdLife International. (2018). Puffinus mauretanicus. The IUCN Red List of Threatened Species 2018: e.T22728432A132658315. https://doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22728432A132658315.en
- BirdLife International. (n.d.). Yellow-breasted bunting (Emberiza aureola). Species factsheet. Retrieved March 5, 2025, from https://datazone.birdlife.org/species/factsheet/yellow-breasted-bunting-emberiza-aureola
- BirdLife International. (2019). Vanellus gregarius (zmieniona wersja oceny z 2018 r.). Czerwona Księga Gatunków Zagrożonych IUCN 2019: e.T22694053A155545788. https://doi.org/10.2305/IUCN.UK.2019-3.RLTS.T22694053A155545788.en
- Heim, W., Anisimov, Y., Bastardot, M., Davaasuren, B., Nakul, G., Anisimova, V., Batbayar, N., Beermann, I., Aung, T. D. W., Damrow, L., Erdenechimeg, T., Hahn, S., Heim, A., Heim, R. J., Hölzel, N., Kunz, F., Levashkin, A., Sander, M. M., Sankamethawee, W., Thomas, A., & Kamp, J. (2024). Migration routes and adult survival of the critically endangered yellow-breasted bunting Emberiza aureola. Scientific Reports, 14(1), 30593. https://doi.org/10.1038/s41598-024-30593-1
- Integrated Taxonomic Information System. (n.d.). Cricetus cricetus (Linnaeus, 1758). Retrieved from https://www.itis.gov/servlet/SingleRpt/SingleRpt?search_topic=TSN&search_value=1136445#null
- Kapler, A. (2024, 19 września). Norka europejska Mustela lutreola – rodzimy gatunek, który pilnie wymaga ochrony. W: Wodne Sprawy. https://wodnesprawy.pl/nauka/norka-europejska-mustela-lutreola-rodzimy-gatunek-ktory-pilnie-wymaga-ochrony
- Maran, T., Skumatov, D., Gomez, A., Põdra, M., Abramov, A. V., & Dinets, V. (2016). Mustela lutreola. The IUCN Red List of Threatened Species, 2016, e.T14018A45199861. https://doi.org/10.2305/IUCN.UK.2016-1.RLTS.T14018A45199861.en
- Planet of Birds. (n.d.). Planet of Birds. https://planetofbirds.com/
- Plants of the World Online. (n.d.). Fraxinus pennsylvanica Marshall. Retrieved March 7, 2025, from https://powo.science.kew.org/taxon/urn:lsid:ipni.org:names:105864-2
- Rusin, M. (2024). Spermophilus suslicus. The IUCN Red List of Threatened Species 2024: e.T20492A221789753. https://dx.doi.org/10.2305/IUCN.UK.2024-2.RLTS.T20492A221789753.en
- rybyswiata.pl. (n.d.). Aloza (Alosa alosa). https://rybyswiata.pl/aloza\
- Sabovljevic, M., Blockeel, T., Hallingbäck, T., Ignatov, M., Papp, B., Schröck, C., & Söderström, L. (2019). Hypnum fertile (errata version published in 2019). The IUCN Red List of Threatened Species 2019, e.T87462920A156115010. https://doi.org/10.2305/IUCN.UK.2019-2.RLTS.T87462920A156115010.en
- Sexton, C. (n.d.). Balearic shearwaters have a remarkable response to climate change. Earth.com. Retrieved from https://www.earth.com/news/balearic-shearwaters-have-a-remarkable-response-to-climate-change/