Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Ptaki, Ssaki, Ryby, Rośliny. Stan na 11 marca 2025 r.
Zagrożona bioróżnorodność, zagrożone życie Europy i Świata. Część. 2
Przedstawiamy drugą część naszego cyklu o zagrożonych gatunkach. Tym razem przyglądamy się ptakom, ssakom i rybom, które trafiły na Europejską Czerwoną Listę Gatunków Zagrożonych, opracowaną przez Międzynarodową Unię Ochrony Przyrody (IUCN).
W Polsce żyją 43 gatunki oficjalnie uznane za zagrożone, a wśród nich 13 gatunków ptaków, ssaków, ryb i roślin których przyszłość stoi pod dużym znakiem zapytania. Ich liczebność dramatycznie spada, a czynniki takie jak zmiany klimatyczne, degradacja siedlisk, działalność człowieka i kłusownictwo sprawiają, że ich los jest coraz bardziej niepewny.
Jakie gatunki znalazły się w gronie najbardziej zagrożonych? Co sprawia, że ich populacje kurczą się w tak szybkim tempie? I wreszcie – czy jesteśmy w stanie zatrzymać ten proces? Odpowiedzi na te pytania znajdziecie w tej części naszego cyklu. Przyroda nie czeka – czas działać, zanim niektóre z tych zwierząt znikną na zawsze.
Ptaki:
Drop Wielki. Great Bustard (Otis tarda)
Kaczka białogłowa. White-headed Duck. (Oxyura leucocephala)
Raróg (zwyczajny). Sokół Raróg. Saker Falcon. (Falco cherrug)
Ścierwnik. Sęp egipski. Orzeł egipski. Egyptian Vulture. (Neophron percnopterus).
Ssaki:
Królik europejski, Królik dziki. European Rabbit (Oryctolagus cuniculus)
Wiewiórka europejska. Wiewiórka ziemna. Suseł moręgowany. Susłak europejski. European Ground Squirrel (Spermophilu)
Ryby:
Niegładzica. Gładzica amerykańska. Flądra amerykańska. Gładzica kanadyjska. American Plaice.
(Hippoglossoides platessoides)
Sieja Pejpus. Peipsi Whitefish (Coregonus maraenoides)
Rośliny:
Aldrowanda pęcherzykowata. Bladderwort (Aldrovanda vesiculosa)
Jarząb sudecki. Majovskya sudetica. Pyrus sudetica. (Sorbus sudetica)
Krótkoszek aksamitny. (Brachytheciastrum vanekii)
Nees’ Hornwort (Anthoceros neesii)
Warzucha polska. Polish Scurvy-grass. (Cochlearia polonica)
Krytycznie zagrożone gatunki występujące w Polsce (CR) zawiera 11 gatunków ptaków (4), ssaków (2), ryb (2), roślin (5)
PTAKI

1. Drop Wielki. Great Bustard (Otis tarda)
Na świecie: Drop duży Otis tarda został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2023 r. Otis tarda znajduje się na liście gatunków zagrożonych
W Europie: Drop duży Otis tarda został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Otis tarda jest gatunkiem o najmniejszej trosce.
Informacje identyfikacyjne
Duży, szaro-brązowy drop o długości 75–105 cm. Charakteryzuje się szarą głową i szyją oraz brązowo-czarnym pręgowaniem na grzbiecie. Spód ciała biały, u dorosłych samców wzbogacony o czerwonobrązowy pas piersiowy, który rozwija się z wiekiem.
Dymorfizm płciowy jest wyraźny – samce są znacznie większe od samic, a w okresie godowym wyróżniają się workiem gardłowym i długimi, białymi “wąsami”.
Wyróżnia go wyprostowana postawa i stateczny chód. W locie uderzenia skrzydeł są silne i regularne, przypominające orła, ale gatunek ten nie szybuje.
Głos: Samce podczas prezentacji godowej wydają pusty dźwięk „umb”. Krzyk alarmowy to krótkie, nosowe szczeknięcie, a młode ptaki porozumiewają się cichym, trelowym wołaniem.
Populacja
Gatunek ten odnotował gwałtowny spadek liczebności na większości obszaru swojego występowania, głównie z powodu utrady, degradacji i fragmentacji siedlisk. Główne zagrożenia to intensyfikacja rolnictwa, ekspansja przemysłowa, w tym rozwój energetyki, a także zmiany klimatu, które nasilają te skutki poprzez wzrost częstotliwości ekstremalnych zjawisk pogodowych i pożarów.
Dodatkowo nielegalne zabijanie, wzrost presji drapieżników oraz zakłócenia w siedlisku przyczyniają się do dalszych strat. Rozwój i modernizacja sieci drogowej zwiększają dostęp do obszarów lęgowych, potęgując zagrożenia.
Obecnie spadek populacji określany jest jako szybki, jednak przewiduje się, że w najbliższej przyszłości tempo to drastycznie wzrośnie, prowadząc do dalszego regresu w ciągu kolejnych trzech pokoleń. W związku z tym gatunek ten klasyfikowany jest jako zagrożony.
Globalna populacja gatunku szacowana jest na 29 600–33 000 osobników, przy czym około 74% z nich występuje w Hiszpanii. W ostatnich latach odnotowano znaczne spadki liczebności, zwłaszcza w Chinach, Rosji, Portugalii i Hiszpanii. Populacja zmniejszyła się o około 36% między 2004 a 2019 rokiem, a tempo tego spadku przyspiesza.
Wielka Brytania prowadzi program reintrodukcji, w ramach którego liczba osobników wzrosła do około 100 w 2022 roku, jednak populacja ta pozostaje kontrolowana i nie jest włączona do globalnych szacunków.
Trendy populacyjne
Historyczne i obecne dane wskazują na ciągły spadek populacji, napędzany głównie przez utrata siedlisk, intensyfikację rolnictwa, rozwój infrastruktury oraz kolizje z liniami energetycznymi. W niektórych regionach dodatkowym zagrożeniem są nielegalne polowania i zatrucia. Prognozy wskazują, że w okresie 2004–2040 liczebność może zmniejszyć się o 49–75%, co kwalifikuje gatunek jako zagrożony.
Dalsze negatywne zmiany mogą zostać spotęgowane przez zmiany klimatu, które przyczyniają się do degradacji środowiska, zwiększając częstotliwość pożarów i ekstremalnych zjawisk pogodowych. W związku z tym przewiduje się, że tempo spadku populacji utrzyma się na poziomie 50–79% w ciągu kolejnych trzech pokoleń.
Sytuacja w Polsce
Ambitna reintrodukcja
Po dekadach nieobecności dropia na polskich ziemiach w 2018 roku Lasy Państwowe postanowiły przywrócić go rodzimej faunie. Program “Reintrodukcja dropia zwyczajnego Otis tarda na terytorium Rzeczypospolitej Polskiej” miał na celu odbudowę dzikiej populacji. Kluczowym elementem projektu było stworzenie Ośrodka Hodowli Dropia w Nadleśnictwie Świebodzin. To tam miały być sprowadzane ptaki z zagranicy, by stworzyć stabilną populację zdolną do samodzielnego funkcjonowania w polskich warunkach.
Nagłe zakończenie projektu
Choć inicjatywa budziła ogromne nadzieje, już w lipcu 2019 roku Dyrektor Generalny Lasów Państwowych wydał zarządzenie nr 37, które skutecznie przerwało realizację programu. Oficjalnych powodów decyzji nie podano, ale spekuluje się, że mogły na nią wpłynąć trudności organizacyjne, wysokie koszty oraz brak gwarancji powodzenia przedsięwzięcia.
Czy dropie wrócą do Polski?
Mimo zamknięcia oficjalnego programu nadzieja na powrót tych majestatycznych ptaków do Polski nie umarła. W 2023 roku pojawiły się informacje o nowych planach wypuszczenia dropi na wolność jesienią 2024 roku. Tym razem działania mają być bardziej kompleksowe, oparte na wnioskach wyciągniętych z wcześniejszych nieudanych prób.
Eksperci podkreślają, że reintrodukcja to długotrwały proces wymagający wieloletniego zaangażowania i współpracy między instytucjami ochrony przyrody, rolnikami i naukowcami. Kluczowe będzie odpowiednie przygotowanie siedlisk oraz zapewnienie dropiom bezpiecznych warunków do lęgu.
Choć drop zwyczajny nie gnieździ się już w Polsce, to wciąż pojawiają się doniesienia o jego sporadycznych obserwacjach. Pojedyncze osobniki przylatują do nas z Niemiec, gdzie wciąż istnieje niewielka populacja tych ptaków. Ich obecność daje nadzieję, że przy odpowiednich warunkach dropie mogą ponownie zadomowić się w naszym kraju.
Siedlisko i ekologia
Pierwotnie gatunek ten zamieszkiwał eurazjatyckie stepy, ale przystosował się do krajobrazów rolniczych. Występuje na otwartych terenach, preferując niską roślinność i mozaikę ekstensywnych upraw (zboża, rośliny pastewne, ugory, pastwiska, stepowe łąki). W Europie zasiedla także dębowe dehesy i gaje oliwne, a w Azji stepy, tereny półpustynne i podnóża gór. Podgatunek wschodni zamieszkuje dodatkowo stepy leśne, wykorzystując drzewa jako osłonę i źródło pożywienia.
Jego dieta jest zróżnicowana i obejmuje bezkręgowce, rośliny, nasiona oraz małe kręgowce (ssaki, gady, ptaki).
Rozród
Do skutecznego lęgu wymaga spokojnych terenów z obfitością owadów. Gniazduje na łąkach, ugorach i polach zbóż, wybierając miejsca o dobrej widoczności i niskim poziomie zakłóceń. Podgatunek wschodni często gniazduje na skrajach lasów i w mozaikach rolniczych.
Migracja
Występują różne strategie migracyjne, zależne od regionu. W Azji większość populacji migruje zimą, w Iranie są to migracje krótkodystansowe, a w Europie Środkowej migracja jest częściowa. Populacje iberyjskie wykazują zróżnicowane wzorce migracji zależne od płci, a w Azji Środkowej gatunek tworzy duże zimujące stada.
Zagrożenia
Gatunek jest narażony na degradację i utratę siedlisk spowodowaną intensyfikacją rolnictwa, zmianami użytkowania gruntów i rozwojem infrastruktury. Procesy te przyspieszają zarówno w Europie, jak i Azji, a ich skutki potęgują zmiany klimatu oraz niska reprodukcja.
Kluczowe zagrożenia:
- Utrata siedlisk – zaorywanie łąk, nadmierny wypas, rozwój dróg, linii energetycznych, systemów nawadniających i urbanizacja.
- Zanieczyszczenia i środki chemiczne – pestycydy ograniczają zasoby pokarmowe i mogą zaburzać układ hormonalny ptaków, a maszyny rolnicze, nawozy i ogień zwiększają śmiertelność jaj, piskląt i samic wysiadujących.
- Kolizje z infrastrukturą – zderzenia z liniami energetycznymi i turbinami wiatrowymi stanowią jedną z głównych przyczyn śmiertelności dorosłych osobników i mogą nasilać się wraz z rozwojem energetyki odnawialnej.
- Łowiectwo i kłusownictwo – nielegalne polowania i zatrucia występują w wielu krajach, zwłaszcza tam, gdzie zimują duże stada. Zbieranie jaj i handel dzikimi ptakami dodatkowo osłabiają populację.
- Zakłócenia – obecność ludzi, pojazdów i myśliwych zmniejsza sukces lęgowy oraz wpływa na kondycję ptaków.
- Zmiany klimatu – ekstremalne zimy zwiększają śmiertelność dorosłych osobników, a intensywne opady latem prowadzą do utraty lęgów. Coraz częstsze pożary mogą niszczyć siedliska i gniazda.
- Drapieżnictwo – zagrożenie stanowią głównie psy domowe oraz polowania na jaja i pisklęta przez inne drapieżniki w niezrównoważonych ekosystemach.
Kumulacja tych czynników prowadzi do spadku liczebności populacji i zwiększa ryzyko dalszego zaniku gatunku.

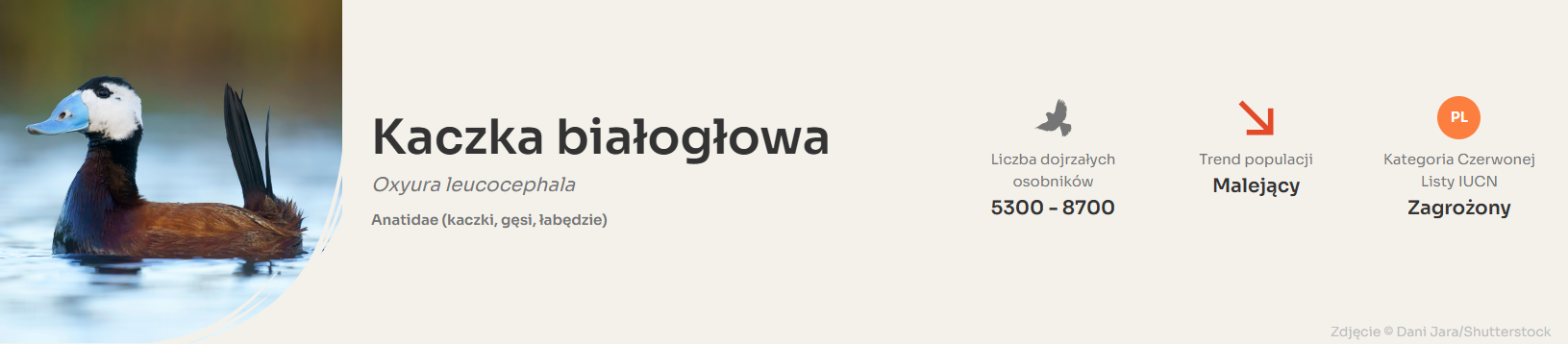
2. Kaczka białogłowa. White-headed Duck. (Oxyura leucocephala)
Na świecie Kaczka białogłowa Oxyura leucocephala została ostatnio wpisana na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2017 r. Oxyura leucocephala znajduje się na liście gatunków zagrożonych.
W Europie została ostatnio oceniona i sklasyfikowana jako gatunek narażony na wyginięcie
Identyfikacja
Kaczka nurkująca o długości 43–48 cm, charakteryzująca się kasztanowobrązowym upierzeniem i długim, często zadartym ogonem.
- Samiec: biała głowa z czarną czapką, niebieski dziób spuchnięty u nasady.
- Samica: blada twarz z ciemną czapką i paskiem na policzku, czarniawy, mniej spuchnięty dziób.
Podobne gatunki
Ruddy Duck (Oxyura jamaicensis) jest mniejszy, ma jaśniejsze kasztanowe upierzenie i węższą czarną czapkę. Samiec ma ciemniejszą tylną szyję, a samica węższy pas twarzy i brązowszą czapkę. Obie płcie nie mają spuchniętej podstawy dzioba. Identyfikacja mieszańców może być trudna.
Głos
Niski, grzechoczący dźwięk podczas pokazu, poza tym zwykle milcząca.
Zakres występowania
Gatunek zamieszkuje Hiszpanię, Algierię i Tunezję, a większa populacja rozmnaża się głównie w Rosji, Kazachstanie, Turcji, Iranie, Afganistanie, Tadżykistanie, Turkmenistanie, Uzbekistanie, Armenii i Mongolii. Jego status w Chinach jest niejasny, ale wydaje się, że jest tam bardzo rzadki i zanikający. Podczas migracji i zimą spotykany jest we wschodniej części Morza Śródziemnego, na Bliskim Wschodzie oraz w centralnej i południowej Azji.
Na początku XX wieku populacja przekraczała 100 000 osobników, lecz do 1996 roku spadła do około 20 000, a później do 8000–13 000. Jednak liczenie w Kazachstanie w 2016 r. wykazało 20 000 ptaków, co sugeruje, że wcześniejsze szacunki mogły być zaniżone. Mimo to populacje lęgowe wyginęły w wielu krajach Europy i Bliskiego Wschodu.
Trendy populacyjne są trudne do określenia, gdyż liczebność na zimowiskach waha się w zależności od dostępności wody. W Turcji w Burdur Gölü liczba ptaków spadła z 10 927 w 1991 r. do 653 w 2001 r., a w całym kraju w 2005 r. było ich jedynie 1006, co oznacza spadek o 60–80% w latach 2002–2012. W Pakistanie populacja zmniejszyła się z 1039 osobników w 1968 r. do zaledwie kilku w XXI wieku.
Wzrost liczebności odnotowano w Izraelu, Syrii, Grecji i Hiszpanii, jednak nie rekompensuje on spadków w Turcji i Azji Środkowej. Istotne koncentracje przelotne występują w Uzbekistanie i Kazachstanie, a małe populacje zimują na Ukrainie.
Populacja i trend liczebności
Globalna populacja kaczki białogłowej szacowana jest na 7900–13 100 osobników, co odpowiada 5300–8700 dojrzałym ptakom. Największe skupiska znajdują się w:
- Hiszpanii i Maroku – ok. 2500 osobników,
- Algierii i Tunezji – 400–600 osobników,
- Wschodnim Morzu Śródziemnym i Azji Południowo-Zachodniej – 5000–10 000 osobników,
- Południowej Azji – zaledwie 10 osobników.
W Europie lęgową populację ocenia się na 250–610 par (500–1200 dojrzałych osobników), a zimującą na 7500–15 900 ptaków. Niezwykle istotne było odkrycie w Kazachstanie w 2016 r., gdzie naliczono ponad 20 000 osobników.
Trendy populacyjne
Analiza danych wskazuje na spadek o 34,4% w latach 2005–2013, co odpowiada 61,3% spadkowi w ciągu 18 lat (trzech pokoleń). Jednak liczby te mogą być zaniżone, ponieważ część populacji mogła zostać pominięta podczas zimowych spisów – przykładem jest Azerbejdżan (5000–10 000 zimujących ptaków w 2014 r.) i Uzbekistan (>5000 ptaków).
Z powodu braków w danych ostrożnie zakłada się globalny spadek o 50–79% w ciągu trzech pokoleń. Konieczne są skoordynowane badania zimowe, aby dokładniej określić faktyczne trendy populacyjne.
Sytuacja w Polsce
W Polsce kaczka białogłowa (Oxyura leucocephala) jest gatunkiem niezwykle rzadkim i nie gniazduje na terenie kraju. Jednakże, w okresie migracji może sporadycznie pojawiać się na polskich wodach jako ptak przelotny. Ze względu na globalny spadek liczebności tego gatunku, kaczka białogłowa jest objęta ścisłą ochroną prawną w Polsce. Wszelkie obserwacje tego gatunku są cenne dla monitoringu jego populacji i powinny być zgłaszane odpowiednim instytucjom ornitologicznym.
Siedlisko i ekologia
Zachowanie
- Migracja: Populacje w Azji Środkowej i Wschodniej są migrujące, natomiast ptaki z Hiszpanii i Afryki Północnej pozostają osiadłe.
- Cykl roczny:
- Lęgi: Kwiecień–lipiec.
- Linienie: Trwa 2–3 tygodnie, po czym w sierpniu ptaki zaczynają migrację na zimowiska, docierając tam we wrześniu-październiku.
- Powrót: Rozpoczyna się w lutym, zakończony w maju.
- Tryb życia:
- Poza sezonem lęgowym: Tworzy duże stada (do 10 000 osobników), choć zwykle liczące mniej niż 500 ptaków.
- Rozmnażanie: Występuje w pojedynczych parach.
Siedlisko
- Lęgi: Małe, zamknięte jeziora słodkowodne lub słonawe, z gęstą roślinnością wynurzoną (Phragmites, Typha), preferujące płytkie wody (0,3–0,5 m głębokości).
- Zimowiska: Większe, głębsze zbiorniki wodne, często słone, z roślinnością zanurzoną (glony, rdestnice). Może występować na lagunach i jeziorach przybrzeżnych, unika otwartych wybrzeży morskich.
Dieta
- Głównie larwy ochotkowatych i inne wodne bezkręgowce (obunogi, równonogi, wieloszczety).
- Pobiera także nasiona i części roślin wodnych (Potamogeton, Ruppia).
Gniazdowanie
- Gniazda nad wodą, wśród gęstej roślinności (Phragmites, Typha).
- Konstrukcja: Platforma z liści i łodyg, czasem z dachem z zagiętych liści.
- Wykorzystuje także stare gniazda łysek lub kaczek oraz skrzynki lęgowe.
 Zagrożenia
Zagrożenia
Hybrydyzacja i konkurencja
- Główne zagrożenie to krzyżowanie się z rudawką jamajską (Oxyura jamaicensis), co prowadzi do genetycznego zalewania.
- Hybrydy i samce rudawki są dominujące nad kaczką białogłową, co utrudnia jej rozmnażanie.
- Rozprzestrzenienie rudawki w Palearktyce może stać się niekontrolowane, zwłaszcza w krajach o dużych terenach podmokłych, takich jak Algieria, Turcja czy Rosja.
Zmiany klimatyczne i utrata siedlisk
- Coraz częstsze susze powodują wysychanie jezior, szczególnie w Azji Środkowej.
- W XX wieku osuszono ok. 50% siedlisk lęgowych; pozostałe są zagrożone przez osuszanie, zanieczyszczenie i zaburzenia środowiskowe.
- Pobór wody do celów rolniczych obniża poziom wód w kluczowych miejscach bytowania.
Niska różnorodność genetyczna
- Populacja zachodnioeuropejska ma niski poziom zmienności genetycznej po kryzysie liczebnym w latach 70. i 80. XX wieku.
- Ogranicza to zdolność adaptacyjną gatunku i jego odporność na zmiany środowiskowe.
Polowania i inne zagrożenia antropogeniczne
- Nielegalne polowania, zbieranie jaj i utonięcia w sieciach rybackich znacząco zmniejszają populację.
- Ptaki połykają ołowiany śrut, co prowadzi do zatruć.
- Polowanie może być główną przyczyną wyginięcia lokalnych populacji.
Badania wskazują, że populacja tego gatunku uległa bardzo szybkiemu spadkowi, co kwalifikuje go jako gatunek zagrożony.
Sokół rarog Falco cherrug został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych IUCN w 2021 r. Falco cherrug znajduje się na liście gatunków zagrożonych.
Opis
Obie płcie mają jednakowe ubarwienie, przy czym samica jest większa od samca. Grzbiet i skrzydła pokrywa szarobrązowe upierzenie z płowordzawymi obrzeżami piór. Ogon zdobią brązowe, poprzeczne pręgi. Głowa jest biała, z podłużnymi brunatnymi pasami, słabo zaznaczonym „wąsem” i brwią oraz rdzawym nalotem. Spód ciała jasny, gęsto pokryty podłużnym brązowym kreskowaniem, które na bokach brzucha zlewa się w jednolity wzór.
Oczy mają brązową barwę, dziób jest szary. Woskówka i nogi u dorosłych ptaków są żółte, natomiast u młodych (do pierwszego roku życia) szaroniebieskie.
Lot niezbyt szybki, często obserwuje się go krążącego na poziomo rozłożonych skrzydłach. Wielkością przewyższa sokoła wędrownego, od którego ma masywniejszą sylwetkę i dłuższy ogon, oraz raroga górskiego, z którym bywa mylony, lecz pozostaje mniejszy od białozora. Poza okresem lęgowym prowadzi samotniczy tryb życia.
Raróg jest drugim najszybszym ptakiem w locie poziomym, ustępując jedynie jerzykowi białogardłemu (choć brak jednoznacznego potwierdzenia). Może osiągać prędkość do 150 km/h (93 mph). W ogólnym zestawieniu najszybszych zwierząt świata zajmuje trzecie miejsce, po sokole wędrownym i orle przednim. Wszystkie trzy gatunki wykonują szybkie nurkowania, znane jako stooping, podczas których mogą osiągnąć nawet 300 km/h (190 mph).
Sokół Raróg jest także ptakiem narodowym Węgier, Zjednoczonych Emiratów Arabskich i Mongolii.
Zasięg geograficzny
Sokół saker zamieszkuje rozległe obszary Palearktyki, rozciągające się od Europy Wschodniej po zachodnie Chiny. Gniazduje w takich krajach jak Armenia, Austria, Bułgaria, Chorwacja, Czechy, Węgry, Mołdawia, Rumunia, Rosja, Serbia, Słowacja, Turcja, Ukraina, Iran, Uzbekistan, Tadżykistan, Kirgistan, Kazachstan, Mongolia i Chiny. Sporadyczne przypadki lęgów odnotowano również w Gruzji, a dawniej także w Turkmenistanie i prawdopodobnie w Afganistanie. Możliwe, że występował również w Iraku i północnych Indiach (Ladakh).
Populacje zimujące oraz osobniki wędrowne regularnie pojawiają się we Włoszech, na Malcie, Cyprze, w Izraelu, Jordanii, Egipcie, Libii, Sudanie, Sudanie Południowym, Tunezji, Etiopii, Kenii, Arabii Saudyjskiej, Jemenie, Omanie, Zjednoczonych Emiratach Arabskich, Bahrajnie, Kuwejcie, Iranie, Pakistanie, Indiach, Nepalu, Afganistanie i Azerbejdżanie. Pojedyncze osobniki mogą docierać także do innych krajów.
Populacja
Globalna populacja sokoła sakera jest trudna do precyzyjnego określenia, jednak szacuje się, że w 1990 roku liczyła około 17 400–28 800 par lęgowych (mediana 22 100), a w 2013 roku spadła do 6100–14 900 par (mediana 10 500). Największe populacje występują w Chinach, Kazachstanie, Mongolii i Rosji.
Europejska populacja jest niewielka i wynosi około 430–630 par, co odpowiada 860–1300 dojrzałym osobnikom.
Trend liczebności wskazuje na wyraźny spadek – w latach 2002–2021 populacja zmniejszyła się o około 44,6%, a przy uwzględnieniu niepewności szacunków, spadek w ciągu trzech pokoleń może wynosić 50–79%.
Siedlisko i ekologia
Sokół saker jest przystosowany do polowania na otwartym terenie, blisko ziemi, łącząc szybkie przyspieszenie z dużą zwrotnością. Jego głównym pożywieniem są średniej wielkości dzienne gryzonie lądowe, zwłaszcza wiewiórki naziemne. Preferuje otwarte krajobrazy, takie jak skraje pustyń, półpustynie, stepy, tereny rolnicze i suche obszary górskie. W pobliżu wody, a także w środowiskach miejskich, częściej poluje na ptaki, a w Europie coraz częściej żywi się gołębiami domowymi.
Gniazduje w zagajnikach, na klifach lub nawet na ziemi, często zajmując stare gniazda innych ptaków. Znosi zwykle od trzech do pięciu jaj, choć zdarzają się lęgi liczące od dwóch do sześciu. Sukces lęgowy zależy od dostępności pokarmu, zwłaszcza w latach cyklicznych wahań populacji gryzoni. Sokół saker występuje samotnie lub w parach.
Tryb życia tego gatunku jest zróżnicowany – część populacji jest osiadła, inne ptaki są częściowo lub całkowicie migrujące, co zależy od dostępności pokarmu zimą. Ptaki wędrowne zimują w Afryce Wschodniej, południowej Europie i południowej Azji, przy czym znacząca część światowej populacji spędza zimę na Wyżynie Tybetańskiej. Opuszczają tereny lęgowe we wrześniu i październiku, a powracają między lutym a majem.
Sytuacja w Polsce
Raróg (sokół saker) w Polsce jest gatunkiem skrajnie rzadkim i niegdyś uznawanym za wymarłego jako ptak lęgowy. Historyczne lęgi odnotowywano do XIX wieku, jednak od tego czasu brak potwierdzonych przypadków regularnego gniazdowania. Obecnie sporadycznie obserwuje się pojedyncze osobniki, głównie przelotne lub uciekinierów z hodowli sokolniczych. Występowanie tych ptaków w Polsce związane jest z ich naturalną migracją oraz możliwością reintrodukcji.
Ze względu na zagrożenia dla globalnej populacji, raróg podlega ścisłej ochronie gatunkowej w Polsce i jest objęty monitoringiem. Niektóre programy ochrony przyrody podejmują działania na rzecz poprawy warunków siedliskowych oraz potencjalnej odbudowy populacji lęgowej w Europie Środkowej.
Zagrożenia
Sokół saker zmaga się z wieloma zagrożeniami, które prowadzą do spadku jego populacji. W Europie główne niebezpieczeństwa to porażenia prądem na liniach energetycznych oraz utrata siedlisk wskutek intensyfikacji rolnictwa, zakładania plantacji i ograniczenia pasterstwa owiec. Zmniejszenie populacji gryzoni, stanowiących główną zdobycz, dodatkowo pogarsza sytuację. Nielegalne odłowy na potrzeby sokolnictwa w przeszłości doprowadziły do lokalnych wyginięć, a obecnie około 8% europejskiej populacji jest każdego roku zabijane lub łapane.
Na innych obszarach główne zagrożenia to odławianie ptaków lęgowych dla sokolnictwa, utrata siedlisk, zatrucia spowodowane stosowaniem pestycydów oraz porażenia prądem. Szczególnie krytyczna sytuacja występuje w Mongolii, gdzie w latach 2013–2018 znaleziono ponad 1700 sokołów śmiertelnie porażonych prądem, głównie młodych osobników. Na Bliskim Wschodzie popyt na sokoły dla sokolnictwa pozostaje wysoki – rocznie odławia się tam kilka tysięcy ptaków, co może zaburzać strukturę wiekową i płciową dzikiej populacji.
Nielegalne odłowy odnotowano także w Chinach, Jordanii i na Kaukazie. Na Wyżynie Tybetańskiej dodatkowe zagrożenia stanowią polityka kontroli gryzoni, rozwój infrastruktury hydroelektrycznej oraz wzrost osadnictwa i sieci energetycznej. Istnieją również obawy o wpływ hybrydyzacji z wypuszczonymi na wolność sokolami hybrydowymi, choć uważa się, że ryzyko to jest niewielkie. Badania sugerują także, że stosowanie nadajników satelitarnych do monitorowania ptaków może negatywnie wpływać na ich przeżywalność.
użytkowanie
Międzynarodowy handel sokół saker na potrzeby sokolnictwa znacząco przyczynia się do spadku jego populacji. Szacuje się, że rocznie na Bliskim Wschodzie odławia się od 6825 do 8400 ptaków, głównie w Arabii Saudyjskiej, Katarze, Bahrajnie, Kuwejcie i Zjednoczonych Emiratach Arabskich. Niektóre badania wskazują jednak na znacznie niższe liczby legalnie odławianych osobników, np. średnio 22 ptaki rocznie w Arabii Saudyjskiej w latach 2002–2009, a w latach 1989–2013 od 19,7 do 575 ptaków rocznie.
Nielegalne odłowy stanowią dodatkowe zagrożenie, zwłaszcza w Chinach, gdzie w prowincji Qinghai każdego roku łapie się co najmniej 1200 sokołów. Przypadki nielegalnego odławiania odnotowano również w Jordanii oraz w Europie Północnej i Środkowej oraz na Kaukazie, gdzie co roku znika około 8% populacji.
Sokół saker jest gatunkiem zagrożonym ze względu na szybki spadek populacji, spowodowany głównie działalnością człowieka. Kluczowe zagrożenia to porażenia prądem na liniach energetycznych, nadmierny odłów na potrzeby sokolnictwa, degradacja siedlisk i wpływ agrochemikaliów. Spadek ten jest szczególnie widoczny na terenach lęgowych w Azji Środkowej.

4. Ścierwnik. Sęp egipski. Orzeł egipski. Egyptian Vulture. (Neophron percnopterus).
W Europie Sęp egipski Neophron percnopterus został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Neophron percnopterus jest sklasyfikowany jako gatunek narażony na wyginięcie
Globalnie Sęp egipski jest wymieniony jako gatunek zagrożony,
informacje identyfikacyjne
Sęp egipski (Neophron percnopterus) to średniej wielkości ptak drapieżny o długości ciała 55–65 cm i rozpiętości skrzydeł wynoszącej 155–170 cm. W locie wyróżnia się szerokimi, „palczastymi” skrzydłami i klinowatym ogonem, co nadaje mu charakterystyczną sylwetkę.
Jego twarz jest intensywnie żółta, a smukły dziób zakończony czarną końcówką. Upierzenie dorosłych osobników jest jasnoszare z delikatnym płowym odcieniem na głowie i szyi. Czarne lotki pierwszorzędowe i drugorzędowe wyraźnie kontrastują z jasnymi pokrywami podskrzydłowymi i charakterystycznymi białymi środkami na górnej stronie skrzydeł.
Młode osobniki mają ciemnobrązowe upierzenie z kontrastującymi, jasnożółtymi akcentami na głowie. Z wiekiem ich pióra stopniowo jaśnieją, aż osiągną typowe dla dorosłych barwy.
zasięg występowania i liczebność gatunku
Sęp egipski ma szeroki zasięg występowania, obejmujący Europę Południową, Afrykę Północną, Bliski Wschód, Azję Środkową i subkontynent indyjski. Populacje rezydencyjne zamieszkują m.in. Wyspy Kanaryjskie, Afrykę Zachodnią, Etiopię, Półwysep Arabski i Indie, natomiast ptaki migrujące rozprzestrzeniają się od północnej Afryki po Azję Środkową.
Liczebność gatunku systematycznie maleje. W Europie populacja spadła o ponad 50% w ciągu ostatnich dziesięcioleci, choć w Hiszpanii i Francji wykazuje oznaki stabilizacji. Sytuacja na Bałkanach i w Grecji pozostaje krytyczna, gdzie liczba osobników spada o 4-8% rocznie. Podobne trendy obserwuje się na Bliskim Wschodzie, choć w Omanie populacja wydaje się stabilna.
W Afryce liczebność sępa egipskiego spada o około 6% rocznie, a w niektórych regionach, takich jak Namibia, gatunek niemal całkowicie wyginął. Szczególnie dramatyczne spadki odnotowano w Indiach, gdzie od 1999 r. liczebność ptaków zmniejszała się o ponad 35% rocznie, głównie z powodu stosowania diklofenaku w weterynarii. Zakaz jego użycia może jednak przyczynić się do zahamowania tego trendu.
Mimo lokalnych sukcesów ochronnych sęp egipski pozostaje gatunkiem zagrożonym i wymaga dalszych działań mających na celu odbudowę populacji.
habitat i ekologia
Sęp egipski gniazduje głównie na półkach skalnych, w jaskiniach klifowych oraz na odsłonięciach skalnych, choć sporadycznie może wykorzystywać także duże drzewa, budynki (zwłaszcza w Indiach), słupy elektryczne, a wyjątkowo nawet ziemię. Żeruje na otwartych, często suchych terenach zarówno w nizinach, jak i w górach, a także w pobliżu osad ludzkich. Jego dieta obejmuje padlinę, żółwie, odpady organiczne, owady, młode kręgowce, jaja, a nawet odchody.
Choć zazwyczaj prowadzi samotny tryb życia, osobniki często gromadzą się w miejscach obfitego pokarmu, takich jak wysypiska śmieci czy specjalne stacje karmienia dla sępów, a ptaki nielęgowe tworzą wspólne noclegownie. Gatunek ten wykonuje charakterystyczne loty godowe, a niektóre populacje wyspiarskie wykazują izolację genetyczną. Północne populacje podejmują długodystansowe migracje międzykontynentalne, zwykle przez najwęższe odcinki Cieśniny Gibraltarskiej, Bosforu i Dardaneli, lecąc głównie nad lądem. Sęp egipski jest wierny swoim siedliskom, zwłaszcza samce wykazują silne przywiązanie do rejonów lęgowych.
obserwacje sępa egipskiego w Polsce
Dotychczasowe obserwacje sępa egipskiego w Polsce są nieliczne i mają charakter wyjątkowy. Gatunek ten preferuje cieplejsze rejony Europy, takie jak Hiszpania, Włochy czy Bałkany, a wędrujące osobniki rzadko docierają tak daleko na północ. Mimo to, istnieją potwierdzone przypadki jego obecności w naszym kraju. Pojedyncze przypadki obecności tego ptaka mogą wynikać z błędów na trasie migracji lub zmian klimatycznych. Jeśli warunki środowiskowe w Europie będą się zmieniać, możliwe, że w przyszłości takie wizyty staną się częstsze. sęp egipski (Neophron percnopterus) podlega w Polsce ochronie ścisłej, mimo że nie jest stałym mieszkańcem kraju
zagrożenia:
- Wysoka śmiertelność: W Hiszpanii liczba terytoriów zmniejszyła się o co najmniej 25% w latach 1987-2000, co odpowiada spadkowi o >50% w ciągu trzech pokoleń, prawdopodobnie z powodu wysokiej śmiertelności.
- Zanikanie populacji: Na Bałkanach populacje spadają o 4-8% rocznie, a w Grecji zmniejszyły się o 44-60% w ciągu 30 lat.
- Spadek liczebności: W regionie Afryki Południowej, Lesotho i Suazi gatunek wyginął. Populacje rezydencyjne w Afryce zmniejszyły się o 5,9% rocznie w ciągu ostatnich 29-36 lat.
- Utrata siedlisk: W Indiach od 1999 r. populacja gatunku uległa katastrofalnemu spadkowi (>35% rocznie), a liczba osobników wykrywanych na odcinkach dróg spadła o 68% w latach 2000-2003.
- Zakaz stosowania diklofenaku: Niedawny zakaz stosowania diklofenaku mógł jednak zahamować spadek populacji w Indiach.
W Maroku sęp egipski jest wykorzystywany w medycynie tradycyjnej, a podobnie jak inne afrykańskie sępy, może mieć wartość handlową jako tradycyjny lek w różnych częściach Afryki.
SSAKI

5. Królik europejski, Królik dziki. European Rabbit (Oryctolagus cuniculus)
Globalnie Królik europejski Oryctolagus cuniculus został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2018 r. Oryctolagus cuniculus jest wymieniony jako gatunek zagrożony.
W Europie Królik europejski jest uznany za gatunek bliski zagrożenia.
opis
Dzikie króliki europejskie ważą od 1,5 do 2,5 kg i osiągają długość 38–50 cm, choć osobniki udomowione mogą być większe. Ich sierść jest zazwyczaj szara z czarnymi, brązowymi lub czerwonawymi plamami, a spodnia strona ciała i ogona jest jaśniejsza. Czasami występują osobniki melanistyczne.
W porównaniu do zajęcy mają mniejsze uszy oraz krótsze i słabsze nogi. Królik europejski jest przodkiem wszystkich udomowionych ras, których obecnie istnieje około 80, różniących się wielkością, rodzajem futra, ubarwieniem i budową ciała.
notatki taksonomiczne
Rodzaj Oryctolagus pojawił się w zapisie kopalnym w środkowym pliocenie, wcześniej niż jakikolwiek inny współczesny zającowaty. Oryctolagus cuniculus był powszechny w rejonie Morza Śródziemnego i Europy Środkowej w plejstocenie, lecz po ostatnim zlodowaceniu jego zasięg ograniczył się do Półwyspu Iberyjskiego i sąsiednich terenów we Francji.
Wyróżnia się dwa podgatunki: O. c. cuniculus, występujący w większości obszarów, na które gatunek został wprowadzony, oraz O. c. algirus, spotykany wyłącznie na Półwyspie Iberyjskim i niektórych wyspach. Badania genetyczne sugerują, że podgatunki te ewoluowały oddzielnie przez około 2 miliony lat, co potwierdzają różnice w genetyce, morfologii, zachowaniu i reprodukcji. Ze względu na izolację reprodukcyjną niektórzy naukowcy proponują traktowanie ich jako odrębne gatunki. Udomowiony królik pochodzi od O. c. cuniculus.
zasięg geograficzny
o ostatniej epoce lodowcowej pierwotny zasięg królika europejskiego obejmował Półwysep Iberyjski, południowo-zachodnią Francję i prawdopodobnie północną Afrykę. Jego introdukcja do zachodniej Europy mogła rozpocząć się już w czasach rzymskich.
Obecnie gatunek ten występuje w większości krajów Europy Zachodniej, a także w Irlandii, Wielkiej Brytanii, Austrii, Szwecji, Polsce, Czechach, na Węgrzech, w Rumunii, na Ukrainie oraz na wyspach Morza Śródziemnego, takich jak Sycylia, Korsyka, Sardynia, Kreta i Baleary. Pojawił się również w Chorwacji i na Słowacji.
Króliki europejskie zostały wprowadzone do Australii i Nowej Zelandii, gdzie są obecnie szeroko rozpowszechnione. W Ameryce Południowej podejmowano wielokrotne próby ich introdukcji od XV wieku, lecz utrzymały się jedynie na ograniczonych obszarach Argentyny i Chile. Gatunek ten zasiedlił także ponad 800 wysp na całym świecie, co świadczy o jego dużej zdolności adaptacyjnej.
Króliki europejskie zamieszkują różnorodne siedliska, zazwyczaj poniżej 1500 m n.p.m., choć na Teneryfie osiągają duże zagęszczenie nawet powyżej 3000 m n.p.m.
stan populacji w Polsce
Królik europejski (Oryctolagus cuniculus) występuje w Polsce, ale jego populacja jest stosunkowo nieliczna i ograniczona do kilku regionów. W przeciwieństwie do zająca szaraka, który jest szeroko rozpowszechniony, królik europejski ma bardziej ograniczony zasięg i preferuje cieplejsze, suche siedliska o luźnej glebie, w których może kopać nory.
Występowanie w Polsce
Króliki europejskie spotykane są głównie w zachodniej i południowo-zachodniej części kraju, szczególnie na terenach o łagodniejszym klimacie, np. w województwach dolnośląskim, lubuskim czy wielkopolskim. Można je znaleźć także na nadmorskich wydmach i w niektórych parkach miejskich. W Polsce ich liczebność jest stosunkowo niska w porównaniu z innymi krajami Europy Zachodniej.
Zagrożenia
Populacja królików europejskich w Polsce zmniejsza się głównie z powodu:
- Chorób wirusowych, takich jak myksomatoza i wirusowa krwotoczna choroba królików (RHD), które zdziesiątkowały ich liczebność.
- Presji drapieżników, w tym lisów, kun i ptaków drapieżnych.
- Utraty siedlisk, spowodowanej zmianami w rolnictwie i urbanizacją.
- Konkurencji z zającem szarakiem, który lepiej przystosował się do polskich warunków.
Status ochronny i łowiecki
W Polsce królik europejski jest gatunkiem łownym, jednak ze względu na jego niską liczebność polowania na niego są rzadkie i nie mają większego znaczenia gospodarczego. W niektórych regionach podejmowane są próby reintrodukcji królików w celu odbudowy populacji.
Mimo że królik europejski nie jest w Polsce gatunkiem inwazyjnym, jak w Australii, jego populacja jest stosunkowo niestabilna i podatna na różne zagrożenia.
populacja
W ostatnich latach populacja królika europejskiego znacznie się zmniejszyła, szczególnie na Półwyspie Iberyjskim. Od 2005 roku odnotowano tam spadek liczebności do zaledwie 5–10% poziomu z 1950 roku. Główną przyczyną tego trendu jest rozprzestrzenianie się chorób wirusowych, takich jak myksomatoza i wirusowa krwotoczna choroba królików (RHD), które znacząco wpłynęły na populacje w całym regionie.
Nowy wariant RHDV2, pojawiający się od 2011–2012 roku, spowodował kolejną falę masowych spadków. W Parku Narodowym Doñana, gdzie króliki były kluczowym ogniwem ekosystemu, populacja zmniejszyła się o ponad 80% w ciągu dwóch lat. Podobne spadki zanotowano również w innych regionach Hiszpanii, w tym w parkach narodowych Andújar i Cardeña, gdzie liczebność królików zmniejszyła się o około 75%.
Zmniejszenie populacji królików miało negatywne konsekwencje dla gatunków drapieżnych, takich jak ryś iberyjski i orzeł cesarski, których wskaźniki płodności znacząco spadły. Ogólny szacowany spadek populacji królików w Europie wynosi 60–70%, co wskazuje na poważne zagrożenie dla stabilności ekosystemów zależnych od tego gatunku.
siedlisko i ekologia
Królik europejski preferuje siedliska o mieszanej strukturze, łączące zarośla zapewniające schronienie i otwarte przestrzenie bogate w trawy i zboża. Choć naturalnie zamieszkuje śródziemnomorskie tereny, coraz częściej spotykany jest na obszarach rolniczych. Buduje nory w miękkiej glebie, ale może również ukrywać się w zaroślach na terenach skalistych. Jest gatunkiem społecznym, żyje w koloniach i prowadzi zmierzchowy tryb życia.
Królik rozmnaża się przez cały rok, choć jego rozród zależy od dostępności zasobów. Samice mogą mieć kilka miotów rocznie, a młode szybko osiągają dojrzałość. Mimo to śmiertelność wśród młodych jest bardzo wysoka, sięgająca 75% w wyniku drapieżnictwa. Średnia długość życia królików wynosi do 9 lat, choć większość nie dożywa tego wieku.
Jest kluczowym gatunkiem ekosystemu, stanowiąc główny składnik diety rysia iberyjskiego i orła cesarskiego. Spadek jego populacji przyczynił się do kryzysu tych drapieżników. Króliki wpływają także na strukturę krajobrazu, wspierając roślinność i zwiększając bioróżnorodność, a ich obecność przyczynia się do wzrostu żyzności gleby.

zagrożenia
Główne zagrożenia dla populacji królika europejskiego to choroby wirusowe, degradacja siedlisk, presja łowiecka i zmiany klimatyczne. Myksomatoza, wprowadzona w latach 50. XX wieku, oraz choroba krwotoczna królików (RHD) spowodowały masowe spadki liczebności. Nowy wariant RHD (GI.2/RHD2/b), pojawiający się od 2011 roku, dodatkowo zdziesiątkował populacje, eliminując także młode osobniki, co utrudnia ich odbudowę.
Utrata siedlisk i ich fragmentacja wynikają z intensyfikacji rolnictwa, urbanizacji oraz zmian w strukturze krajobrazu. Nowoczesne rolnictwo, duże pogłowie zwierząt hodowlanych i zalesianie niektórych obszarów prowadzą do zmniejszenia dostępnych terenów odpowiednich dla królików. Pożary i zmiany klimatyczne dodatkowo pogłębiają te problemy.
Presja łowiecka, zarówno ze strony myśliwych, jak i rolników kontrolujących populację królików, przyczynia się do dalszych spadków. Na obszarach o dużej intensywności polowań odnotowano najsilniejsze negatywne trendy. Ponadto, przyszłe zagrożenia obejmują potencjalne wprowadzenie genetycznie zmodyfikowanych wirusów do kontroli populacji oraz utratę różnorodności genetycznej w wyniku niekontrolowanych reintrodukcji królików.
Królik europejski jest istotnym gatunkiem łownym, a jego udomowione formy pełnią rolę zwierząt domowych i są szeroko wykorzystywane w badaniach laboratoryjnych. Zjada uprawy i konkuruje z zwierzętami gospodarskimi o paszę. W krajach takich jak Australia, Nowa Zelandia, Wielka Brytania i Stany Zjednoczone wydaje się miliony dolarów rocznie na kontrolę jego populacji. Ponadto w niektórych regionach spowodował poważne szkody ekologiczne.

6. Wiewiórka europejska. Wiewiórka ziemna. Suseł moręgowany. Susłak europejski. European Ground Squirrel (Spermophilus citellus)
Wiewiórka ziemna Spermophilus citellus została ostatnio oceniona pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2023 r. Spermophilus citellus znajduje się na liście gatunków zagrożonych.
opis
Wiewiórki ziemne to niewielkie ssaki o zaokrąglonym ciele i krótkim ogonie, których rozmiary zależą od wieku, płci oraz warunków środowiskowych. Mężczyźni osiągają masę od 125 do 380 g, natomiast samice ważą od 131 do 353 g. Długość ciała (mierzonego od głowy do końca tułowia) wynosi odpowiednio od 176 do 228 mm u samców i od 174 do 217 mm u samic, a długość ogona to około 31–90 mm u mężczyzn i 38–75 mm u kobiet.
Gatunek posiada 22 zęby, ułożone według wzoru: jeden siekacz z każdej strony, brak kłów, dwa i jeden przedtrzonowce oraz trzy trzonowce z każdej strony. Małe, spiczaste uszy i szeroko rozstawione oczy umiejscowione wysoko na głowie dodają mu charakterystycznego wyglądu. Ogon jest cylindryczny, bez wyraźnego wzoru kolorystycznego. Futro wiewiórek jest gładkie, o żółtawej barwie na grzbiecie, przechodzącej w jaśniejszy kolor na brzuchu, a na grzbiecie występują plamy tworzące efekt plamistości. Na każdej łapie mają cztery poduszki oraz pazury. Młode osobniki, już w wieku około 30 dni, ważą średnio 61,4 g i rodzą się z wykształconym owłosieniem.
zasięg geograficzny
Wiewiórka ziemna jest gatunkiem endemicznym występującym w środkowej i południowo-wschodniej Europie, na wysokościach od poziomu morza do 2593 m. Jej zasięg jest podzielony przez Karpaty na dwie odrębne części. Północno-zachodnia populacja obejmuje Czechy, Polskę, Austrię, Słowację, Węgry, północną Serbię i zachodnią Rumunię. Południowo-wschodnia część występowania rozciąga się od południowej Serbii, Macedonii Północnej i Grecji przez Bułgarię i południową Rumunię aż po turecką Trację, Mołdawię i Ukrainę.
populacja
Populacja wiewiórki ziemnej w Europie uległa znacznym spadkom i fragmentacji zasięgu. W Niemczech i Polsce doszło do lokalnych wyginięć – w Niemczech gatunek zniknął około 1985 roku, a w Polsce ostatnie pewne zapisy autochtoniczne pochodzą z lat 70., choć gatunek został reintrodukowany w 2005 roku. W optymalnych siedliskach zagęszczenie wynosi od 18 do 48 osobników na hektar, jednak w niektórych obszarach odnotowano zaledwie 5–14 osobników na hektar.
W Austrii, zasięg wynosi około 8600 km², gdzie populacja liczy od 25 000 do 60 000 osobników rozmieszczonych w około 80 metapopulacjach. Długoterminowe badania wykazują zmienność zagęszczenia – od 6,3 do 61 osobników na hektar, przy czym obszary takie jak winnice w Dolnej Austrii i Wiedniu stanowią kluczowy habitat.
W Mołdawii gatunek występuje we wschodniej i środkowej części kraju, z 25 znanymi koloniami, gdzie zagęszczenie waha się od 2-4 do 10-12 osobników na hektar, choć liczebność stale spada mimo ochrony.
W Rumunii zidentyfikowano około 1100 kolonii, z przewagą populacji we wschodniej części (77% kolonii). W zależności od regionu, zagęszczenia burzowych nor wynoszą od 110 do nawet 220 nor na hektar, a siedliska obejmują głównie pastwiska, łąki, obszary przydrożne czy tereny lotniskowe, z częstym wypasem przez owce.
W Polsce prowadzone są programy reintrodukcji, które obecnie skutkują występowaniem gatunku na dwóch stanowiskach z szacunkową liczbą 1000–1400 aktywnych nor.
Na Słowacji, mimo historycznego spadku, intensywne projekty ochronne przyczyniły się do wzrostu liczebności – z szacunków z 2013 roku wynoszących 6000–15 000 osobników, w 2019 roku liczba wzrosła nawet do 20 000, a dzięki projektom LIFE w 2022 roku osiągnięto 36 000 osobników, choć struktura kolonii jest bardzo zróżnicowana.
W Turcji gatunek ograniczony jest do nizin Tracji, występując jedynie w 12 lokalizacjach przy niskich wysokościach.
Na Węgrzech historyczne dane wskazują na utratę około dwóch trzecich kolonii w ciągu ostatnich 50 lat. Monitorowane zagęszczenia wahają się od kilku do kilkuset osobników na hektar, a fragmentacja siedlisk wynika głównie z porzucania trawiastych terenów i zmiany użytkowania gruntów.
W Ukrainie gatunek wyginął w obwodzie zakarpackim, ale nadal występuje w obwodach czerniowieckim i winnickim – szacuje się, że w 2022 roku było około 1640 aktywnych nor.
W Czechach sytuacja uległa poprawie od lat 90. Początkowo liczba kolonii spadła, jednak regularny monitoring wykazał stopniowy wzrost, osiągając w 2008 roku około 3600 osobników, a w 2016 roku około 5000. Jednak późniejsze dane z 2021-2022 wskazują na spadek do około 6000 osobników, przy czym populacje są rozproszone na 40-41 lokalizacjach, a zagęszczenia różnią się w zależności od dostępności sztucznych źródeł pożywienia.
W Serbii populacja jest rozproszona – występuje w fragmentach stepów na północy oraz górskich pastwiskach na południowym wschodzie. Lokalna gęstość waha się od 1 do ponad 100 osobników na hektar, a monitoring w centralnym Banacie wykazał spadek liczby aktywnych kolonii w ciągu kilku lat oraz ograniczenie zasięgu do 70–90% historycznych wartości.
W Bułgarii zasięg występowania wynosi około 110 000 km², jednak gatunek zniknął z południowo-zachodniej i północno-zachodniej części kraju, głównie na skutek intensyfikacji rolnictwa, redukcji liczby zwierząt wypasanych i zmiany użytkowania gruntów, co doprowadziło do utraty około 30% kolonii.
W Macedonii Północnej wiewiórka ziemna występuje na obszarze góry Jakupica (884 ha) z zagęszczeniem od 0,8 do 5,5 osobników na hektar, a całkowita populacja dorosłych szacowana jest na około 2000. Dodatkowo, na nizinach południowo-wschodniej kraju znajduje się co najmniej 15 rozproszonych kolonii, przypisanych do czterech odrębnych populacji.
W Grecji gatunek jest obecny w trzech oddzielnych subpopulacjach na północy, gdzie kolonie są bardzo małe (średnia powierzchnia około 6,4 ha) i charakteryzują się niskim zagęszczeniem – średnio 7,4 osobników na hektar. Badania przeprowadzone w latach 2019–2020 wykazały drastyczny spadek powierzchni występowania i liczby kolonii, z wieloma lokalizacjami zawierającymi mniej niż 10 osobników, a niektóre podgatunki uległy całkowitemu wyginięciu.
Podsumowując, w całej Europie wiewiórka ziemna doświadcza znacznej fragmentacji siedlisk i spadków liczebności, spowodowanych przez intensyfikację rolnictwa, urbanizację oraz rozwój infrastruktury. W wielu krajach wdrażane są projekty ochronne, reintrodukcje i translokacje mające na celu przywrócenie łączności między fragmentami siedlisk oraz stabilizację populacji, choć w niektórych regionach sytuacja pozostaje alarmująca.
habitat i ekologia
Wiewiórka ziemna posiada specyficzne wymagania siedliskowe. Zamieszkuje otwarte, trawiaste tereny z krótką roślinnością, występując na wysokościach do około 2500 m. Preferuje lekką, dobrze zdrenowaną glebę o niskim poziomie wód podziemnych, co umożliwia budowę nor zwykle ulokowanych na podwyższonych partiach płaskiego terenu lub zboczach.
Gatunek ten występuje zarówno w środowiskach naturalnych, jak i półnaturalnych oraz sztucznych. Można go spotkać na stepach, pastwiskach górskich, terenach solnych, a także w krajobrazach wiejskich, takich jak winnice, sady, pobocza dróg czy tereny rekreacyjne (np. boiska, pola golfowe, lotniska). Mimo że potrafi tolerować obecność pojedynczych drzew i krzewów, długotrwałe zdominowanie przez wysoką roślinność nie sprzyja jego przetrwaniu, gdyż gatunek preferuje otwartą przestrzeń zapewniającą dobrą widoczność.
Pod względem diety wiewiórka ziemna jest głównie roślinożerna, żywiąc się zieloną roślinnością, nasionami oraz, w mniejszym stopniu, stawonogami. Jej pożywienie opiera się głównie na roślinach strączkowych i trawach, a dominujące źródła pokarmu zmieniają się sezonowo, w zależności od warunków siedliskowych i praktyk zarządzania.
Ekologicznie, wiewiórka ziemna pełni kilka istotnych funkcji. Jej kopanie nor wpływa na właściwości gleby i zwiększa jej żyzność, a sama obecność gatunku przyczynia się do tworzenia złożonych struktur siedliskowych, które służą jako schronienie dla innych organizmów. Dodatkowo, stanowi ważne źródło pokarmu dla wielu drapieżników, odgrywając kluczową rolę w ekosystemach, które zamieszkuje.

zagrożenia
Główne zagrożenia dla europejskiej wiewiórki susły wynikają przede wszystkim z utraty i degradacji siedlisk. Intensyfikacja rolnictwa, rozwój infrastruktury oraz budowa dróg i innych obiektów prowadzą do przekształcania lub porzucania naturalnych stepowych łąk i pastwisk. W wyniku tego odpowiednie siedliska ulegają fragmentacji i izolacji, co zmusza gatunek do zasiedlania środowisk półnaturalnych i sztucznych, takich jak intensywnie zarządzane trawniki, winnice, lotniska czy pola golfowe.
W wielu krajach – w Austrii, Rumunii, Bułgarii, Serbii, Ukrainie, Mołdawii, a także w Czechach, Słowacji, Węgrzech i Grecji – obserwuje się spadki populacji spowodowane m.in. przez konwersję terenów pod uprawy, zmiany w systemach wypasu i porzucanie tradycyjnych pastwisk. Dodatkowo, bezpośrednie działania pest control, takie jak gazowanie nor czy stosowanie rodentycydów, przyczyniają się do lokalnych wyginięć. Nowe zagrożenia pojawiają się również w wyniku rozwoju odnawialnych źródeł energii – np. budowy elektrowni wiatrowych lub farm słonecznych, które niszczą suche, trawiaste obszary niezbędne do życia tego gatunku.
Zmiany klimatyczne, w tym częstsze ulewne deszcze i powodzie, mogą powodować wzrost poziomu wód gruntowych, co zagraża przetrwaniu osobników podczas hibernacji. Fragmentacja siedlisk prowadzi także do spadku różnorodności genetycznej, zwiększając ryzyko chorób, obniżonej rekrutacji potomstwa oraz ostatecznie nieodwracalnego wyginięcia lokalnych populacji.
W Polsce dodatkowo wiewiórka susła staje przed specyficznymi zagrożeniami. Intensyfikacja rolnictwa oraz rosnące zapotrzebowanie na tereny z suchymi trawami – wykorzystywane pod budowę farm słonecznych i innych inwestycji – powodują, że coraz trudniej znaleźć i utrzymać odpowiednie siedliska.
Zmiany w tradycyjnych systemach wypasu, które nie tylko utrzymują otwartość krajobrazu, ale także wspomagają naturalną równowagę ekosystemu, prowadzą do sukcesji roślinnej, przekształcając łąki w zarośla, co jest niekorzystne dla gatunku. Dodatkowo, mechanizacja rolnicza oraz budowa infrastruktury powodują bezpośrednie niszczenie nor, a stosowanie pestycydów ogranicza dostępność naturalnego pokarmu. Te czynniki, w połączeniu z fragmentacją siedlisk, zwiększają ryzyko spadków liczebności i utrudniają naturalną rekolonizację, co czyni sytuację gatunku w Polsce szczególnie wrażliwą.
Ryby

7. Niegładzica. Gładzica amerykańska. Flądra amerykańska. Gładzica kanadyjska. American Plaice. (Hippoglossoides platessoides).
W Europie Gładzica amerykańska Hippoglossoides platessoides została ostatnio wpisana na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2014 r. Hippoglossoides platessoides jest gatunkiem o najmniejszej trosce.
Na świecie Hippoglossoides platessoides jest wymieniony jako gatunek zagrożony
opis
Gładzica amerykańska Hippoglossoides platessoides została ostatnio oceniona pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2021 r. Hippoglossoides platessoides jest wymieniony jako gatunek zagrożony.
Amerykańska flądra to płaska ryba o charakterystycznej, zaokrąglonej płetwie ogonowej. Młode osobniki mają typowy rybi kształt, lecz w miarę rozwoju i osiadania na dnie oceanu ich ciało ulega spłaszczeniu. W procesie tym lewe oko migruje na prawą stronę, co umożliwia flądrze leżenie płasko na dnie i pływanie na boku.
Górna strona ciała flądry, na której znajdują się oba oczy, ma czerwonobrązową barwę, co pozwala na skuteczny kamuflaż w osadzie, natomiast spód pozostaje biały. Ryba charakteryzuje się dużym pyskiem z rozciągniętą kością szczękową. Płetwa grzbietowa rozpoczyna się nad lewym okiem, a linia boczna jest niemal prosta. Ciało pokrywają szorstkie łuski.
Dorosłe flądry rosną stosunkowo wolno i mogą osiągnąć ponad 60 cm długości. Dojrzałość płciową uzyskują przy długości około 35 cm. Maksymalna zanotowana długość wynosi 82,6 cm, waga – 6,4 kg, a maksymalny wiek – 30 lat.
Flądry te najczęściej występują na głębokości od 90 do 250 m, w wodach o temperaturze dna od -0,5 do 2,5°C. Preferują miękkie dno i żywią się głównie bezkręgowcami oraz małymi rybami. Ich rozród odbywa się poprzez tarło wsadowe.
zasięg geograficzny
American Plaice to gatunek arktyczno-borealny, występujący w północnym Atlantyku oraz przyległych wodach arktycznych. Na wschodnim Atlantyku zasięg obejmuje obszary od wschodniej Grenlandii, Islandii, Wysp Owczych, Jan Mayen, Wysp Brytyjskich, przez Morze Północne i Bałtyk, aż do Zatoki Kolońskiej, norweskiego wybrzeża, Morza Barentsa oraz Spitsbergenu (ok. 50°–70°N), włączając Svalbard, Ziemię Franciszka Józefa, Morze Białe i północno-zachodni Kara. Na zachodnim Atlantyku występuje od zachodniej Grenlandii i obszarów kanadyjskich (m.in. południowa Zatoka Baffina, Cieśnina Davisa, Zatoka Świętego Wawrzyńca, Wielka Ławica, Zatoka Hudsona) aż po Zatokę Śródatlantycką. Gatunek ten najczęściej występuje na głębokościach 10–400 m, choć odnotowano go na głębokościach sięgających do 3000 m – zapisy powyżej 1155 m są jednak bardzo rzadkie.
populacja
Atlantyk Zachodni
Liczebność tego gatunku jest większa w zachodnim niż we wschodnim Atlantyku. Największym historycznie stadem jest Grand Banks (Divs. 3LNO), a inne duże stada obejmują Labrador/Wschodnią Nową Fundlandię (Divs. 2+3K) i Południową Zatokę Świętego Wawrzyńca (Div. 4T). Pięć mniejszych stad występuje w rejonach: Południowej Nowej Fundlandii, USA, Scotian Shelf, Zachodniej Grenlandii i Flemish Cap (Div. 3M). Stado East Greenland jest znacznie mniej liczne.
W ostatnich dekadach liczebność wielu stad spadła. Na Flemish Cap wskaźnik biomasy stada tarłowego zmniejszył się o 31% od 1988 r., ale ostatnie lata przyniosły stabilizację. Stado Zatoki Świętego Wawrzyńca doświadczyło 88% spadku biomasy od 1977 r., a jego odbudowa jest mało prawdopodobna. Stado Labradoru i północno-wschodniej Nowej Fundlandii odnotowało 88% spadek liczebności między 1978 a 2011 r., pomimo niskiej śmiertelności połowowej. Grand Banks (Divs. 3LNO) spadło o 85% od 1972 r., ale od wprowadzenia moratorium w 1993 r. obserwuje się powolny wzrost. Na szelfie szkockim biomasa zmniejszyła się o 85–90% od lat 80. W USA populacja w Zatoce Maine i Georges Bank zmniejszyła się o 40% od 1980 r., ale w ostatnich latach wzrasta.
Atlantyk Wschodni
Wschodni Atlantyk charakteryzuje się niską liczebnością tego gatunku. W Morzu Północnym jest on poławiany głównie jako przyłów i wyrzucany. Największa biomasa występuje na północ od ławicy Dogger, a najmniejsza na szelfie Wschodniej Grenlandii. Gatunek ten jest liczny w rejonie Jan Mayen, Grenlandii, Islandii i Morza Barentsa, a także w Morzu Karskim.
Na Islandii biomasa spadła o 68% od 1999 do 2020 r., mimo wzrostu rekrutacji od 2007 r. Na Grenlandii zachodniej biomasa wzrosła od lat 90., ale pozostaje niższa niż w latach 80. Stado Flemish Cap odbudowuje się od 2007 r., lecz NAFO zaleca minimalizację połowów. Na szelfie szkockim oraz w Nowej Fundlandii temperatury przydenne wzrastają, co może wpływać na niską biomasę.
Podsumowując, w wielu regionach Atlantyku zachodniego i wschodniego populacje tego gatunku zmniejszyły się drastycznie, a w niektórych przypadkach odbudowa jest mało prawdopodobna.
habitat i ekologia
American Plaice to zimnowodny, przydenny gatunek, który zamieszkuje szelf kontynentalny oraz zbocza, preferując piaszczyste lub muliste dno. Występuje przede wszystkim w wodach o temperaturze od -1,5 do 2,5 °C, najczęściej na głębokościach między 100 a 300 m, choć zdarzają się odnotowania na większych głębokościach. Gatunek podejmuje ograniczone migracje w celu tarła, żerowania lub w odpowiedzi na zmiany temperatury – tarło zwykle odbywa się na głębokościach 60–90 m. Niektóre subpopulacje, takie jak te w Morzu Barentsa, nie wykazują migracji tarłowej, a migracyjne zachowania w okolicach Svalbardu pozostają niejasne.
American Plaice rośnie powoli i osiąga stosunkowo duże rozmiary, choć wielkość osobników zależy od regionu – maksymalna całkowita długość wynosi do około 82,6 cm, jednak we wschodnim Atlantyku osobniki są zazwyczaj mniejsze, a w wodach USA osiągają rozmiary rzędu 60–70 cm. Szacuje się, że maksymalny wiek tego gatunku waha się od 11 lat na Morzu Północnym, przez 20–25 lat w Morzu Barentsa, aż po 27–30 lat w bardziej południowych rejonach Zatoki Świętego Wawrzyńca oraz u wybrzeży Nowej Fundlandii.
Harmonogram dojrzewania jest bardzo zmienny i zależy od warunków środowiskowych. Osobniki z południowej części zasięgu rosną szybciej i osiągają dojrzałość wcześniej niż te z północnych rejonów. W Morzu Północnym osiągają dojrzałość już w wieku 2–3 lat, podczas gdy w innych rejonach, jak Morze Barentsa czy zachodni Atlantyk, wiek pierwszej dojrzałości może być znacznie wyższy – od około 4 lat do nawet ponad 10 lat, zależnie od lokalnych warunków, takich jak temperatura wody.
Dodatkowo, zmienność czasowa wywołana czynnikami rybołówstwa i środowiskowymi sprawia, że wiek osiągnięcia dojrzałości u samic uległ skróceniu z około 11 lat do 7,5–8 lat w niektórych rejonach. Naturalna śmiertelność również wykazuje regionalne różnice – na przykład w południowej części Zatoki Świętego Wawrzyńca wzrosła z 0,25 do 0,5 w ciągu ostatnich dekad, co przy generacyjnej długości około 15–16 lat odzwierciedla umiarkowanie długowieczny charakter tego gatunku.

zagrożenia
Historyczne przełowienie stanowiło istotne zagrożenie dla tego gatunku, jednak zmiany środowiskowe, szczególnie trend ocieplenia klimatu, obecnie odgrywają kluczową rolę w jego spadku.
Ocieplenie wód u wybrzeży południowej Nowej Fundlandii, na Flemish Cap, Grand Banks, północno-wschodnim szelfie kontynentalnym USA oraz na Oceanie Arktycznym negatywnie wpływa na populacje tego zimnowodnego gatunku. Dodatkowo, zwiększona śmiertelność spowodowana intensywnym drapieżnictwem przez foki szare utrudnia odbudowę populacji, zwłaszcza w Zatoce Świętego Wawrzyńca.
sytuacja a Polsce
Gładzica amerykańska (Hippoglossoides platessoides), znana również jako niegładzica, występuje w chłodnych wodach północnego Atlantyku, w tym w zachodniej części Morza Bałtyckiego. W Polsce jej obecność jest ograniczona – nie jest to gatunek typowy dla polskiej strefy Bałtyku, jednak sporadycznie może być spotykana w głębszych rejonach akwenu.
W polskich wodach Bałtyku głównymi gatunkami ryb płaskich są storniowate, w tym gładzica (Platichthys flesus), jednak niegładzica nie odgrywa znaczącej roli w komercyjnym rybołówstwie. Ze względu na preferencję dla chłodniejszych i głębszych wód, jej występowanie w polskiej części Bałtyku jest rzadkie i nie ma większego znaczenia gospodarczego.
Obecnie w kontekście ochrony przyrody i zmian środowiskowych w Bałtyku nie odnotowuje się szczególnych zagrożeń ani działań ochronnych dotyczących tego gatunku w Polsce. Jednak zmiany klimatyczne i ocieplanie się wód Bałtyku mogą ograniczać jej obecność w regionie, wypierając populację na północ.
Status i zagrożenia
W polskiej części Bałtyku niegładzica jest poławiana głównie jako przyłów w połowach komercyjnych, ale nie odgrywa istotnej roli gospodarczej. Ze względu na swoją ograniczoną liczebność i wrażliwość na zmiany środowiskowe, może być narażona na negatywne skutki działalności człowieka.
Główne zagrożenia dla niegładzicy w Polsce to:
- Zmiany klimatu – ocieplenie wód Bałtyku może wpływać na dostępność odpowiednich siedlisk oraz pokarmu dla tego gatunku.
- Zanieczyszczenie wód – nadmiar biogenów prowadzący do eutrofizacji może pogarszać warunki tlenowe w głębszych partiach morza, gdzie niegładzica przebywa.
- Połowy komercyjne – chociaż gatunek ten nie jest celem intensywnych połowów, bywa odławiany jako przyłów w połowach innych gatunków ryb dennych.
Ochrona i perspektywy
Obecnie niegładzica nie znajduje się na liście gatunków zagrożonych w Polsce, ale jej populacja powinna być monitorowana pod kątem zmian liczebności i wpływu czynników środowiskowych. Wprowadzenie odpowiednich regulacji dotyczących połowów i ochrony siedlisk może pomóc w zachowaniu stabilności tego gatunku w polskich wodach.
eksploatacja komercyjna
Gładzica amerykańska ma długą historię eksploatacji komercyjnej. Intensywne połowy rozpoczęły się w zachodnim Atlantyku w latach 40. XX wieku, a w kolejnych dekadach objęły szersze obszary. W Kanadzie gatunek ten jest jednym z czterech najważniejszych gatunków ryb płaskich poławianych w rybołówstwie atlantyckim. W Stanach Zjednoczonych stanowił istotny cel połowów ryb dennych, jednak obecnie większość stad zachodniego Atlantyku jest zamknięta dla ukierunkowanych połowów, dlatego gładzica amerykańska trafia do sieci głównie jako przyłów w połowach innych gatunków. Wykorzystywane są do tego włoki rozpornicowe, sieci niewodowe i długie linki. Przykładem jest wzrost przyłowu tego gatunku w połowach halibuta grenlandzkiego u wybrzeży Labradoru od 1999 roku.
We wschodnim Atlantyku gładzica amerykańska jest poławiana jako przyłów w połowach trawlerami, głównie podczas połowów sola i żabnicy, a także w ramach mieszanych połowów przydennych. Jest również przedmiotem połowów komercyjnych w wodach rosyjskich. Po złowieniu ryby najczęściej trafiają na rynek jako świeże lub mrożone filety. Ze względu na głębokowodne siedliska, gładzica amerykańska nie jest popularnym celem połowów rekreacyjnych.
Gatunek ten często trafia jako przyłów także do połowów krewetek w Zatoce Maine, gdzie wskaźnik odrzutów sięga 81%. Śmiertelność odrzuconych ryb jest prawdopodobnie wysoka, ponieważ mniej niż 10% osobników większych niż 30 cm przeżywa dłuższy czas przebywania na pokładzie.

8. Sieja Pejpus. Peipsi Whitefish. (Coregonus maraenoides)
Sieja peipsijska Coregonus maraenoides została ostatnio oceniona pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych IUCN w 2023 r. Coregonus maraenoides jest wymieniony jako gatunek zagrożony.
Opis.
Sieja Pejpus (Coregonus lavaretus) to ryba z rodziny łososiowatych o charakterystycznym, wydłużonym i lekko spłaszczonym ciele. Jej wygląd można opisać następująco:
🔹 Kolor: Srebrzyste łuski z niebieskawym lub zielonkawym odcieniem na grzbiecie.
🔹 Pysk: Stosunkowo mały, z lekko wysuniętą górną szczęką.
🔹 Płetwy: Przezroczyste lub szarawe, grzbietowa mała, a ogonowa mocno wcięta.
🔹 Budowa: Smukłe ciało, dostosowane do szybkiego pływania.
Maksymalna długość ciała to 60 cm SL (standard length), odnotowana u samców oraz osobników o nieokreślonej płci (Ref. 59043). Siei Pejpus można spotkać zarówno w jeziorach, jak i rzekach. Główne obszary tarłowe znajdują się w południowej strefie przybrzeżnej jeziora Peipus oraz w północnej części jeziora Teploe. W okresie rozrodu gatunek ten wpływa także do niektórych rzek, gdzie składa ikrę.
Zasięg geograficzny
Sieja Pejpus to endemiczny gatunek ryby, występujący wyłącznie w jeziorze Pejpus, leżącym na granicy Estonii i Federacji Rosyjskiej, oraz w połączonym z nim estońskim jeziorze Võrtsjärv. W ciągu ostatnich kilkunastu lat jej populacja zmniejszyła się o ponad 50%, co – biorąc pod uwagę długość pokolenia wynoszącą pięć lat – oznacza drastyczny spadek w okresie trzech pokoleń. Z tego powodu gatunek został sklasyfikowany jako zagrożony (kategoria EN) zarówno na poziomie globalnym, jak i w krajach członkowskich.
Choć próbowano ją wprowadzić do wielu europejskich i azjatyckich akwenów, w większości przypadków nie udało jej się zadomowić.
Nie inaczej było w Polsce. Mimo że sieję Pejpus introdukowano do niektórych jezior, nie powstały tu samowystarczalne populacje. Oznacza to, że pojedyncze osobniki mogły pojawiać się w naszych wodach, ale gatunek nie utrwalił swojej obecności.
Podobna sytuacja miała miejsce także w Niemczech, Holandii, Rumunii, Bułgarii czy na Ukrainie. Jednak ze względu na brak pewności co do trwałości tych populacji, nie można dokładnie określić jej obszaru występowania poza naturalnym środowiskiem.
Populacja
Zapisy wskazują, że sieja Pejpus nigdy nie była gatunkiem szczególnie licznym w ekosystemie jeziora Peipus. Mimo to jej populacja od lat 90. zaczęła gwałtownie maleć, a od 2010 roku zmniejszyła się o ponad 50%. To alarmujące tempo spadku, które budzi obawy o przyszłość gatunku.
Siedlisko i ekologia
Sieja Pejpus zasiedla zarówno jeziora, jak i ich dopływowe rzeki, preferując chłodne, czyste wody. Jest gatunkiem wszystkożernym – młode osobniki odżywiają się głównie zooplanktonem i bezkręgowcami bentonicznymi, podczas gdy dorosłe osobniki polują także na drobne ryby. Żyje nawet 15 lat, a dojrzałość płciową osiąga między 4. a 5. rokiem życia. Tarło odbywa się od października do grudnia, wśród trzcin, na głębokości 1–5 metrów, gdy woda ma mniej niż 5°C. Jaja rozwijają się przez zimę, a wylęg następuje pod koniec kwietnia, gdy temperatura wody wzrasta do 6–8°C.
Zagrożenie
Jezioro Peipus zmaga się z poważnym problemem eutrofizacji, co negatywnie wpływa na ekosystem i warunki życia wielu gatunków, w tym siei Pejpus. Dodatkowym zagrożeniem jest intensywne przeławianie – zarówno celowe, jak i jako przyłów w masowych połowach sandacza zwyczajnego (Sander lucioperca), który stanowi główny cel komercyjnego rybołówstwa w tym akwenie.
Rośliny

9. Aldrowanda pęcherzykowata. Bladderwort (Aldrovanda vesiculosa)
opis.
Roślina: Pływająca, nieposiadająca korzeni.
Łodyga: Może być pojedyncza lub rozgałęziona, osiągając długość do 30 cm.
Liście: Ułożone w okółkach po 5–9 sztuk, o długości 10–15 mm. Każdy liść ma blaszkę podzieloną na dwie części, pokrytą szczecinkami wrażliwymi na dotyk – są to tzw. liście pułapkowe.
Kwiaty: Drobne, białe, umieszczone na długich szypułkach. Wykazują wyraźny podział na kielich i koronę, przy czym działki kielicha są równe długością płatkom korony.
Zasięg geograficzny
Rozprzestrzenienie historyczne
Historycznie, Aldrovanda vesiculosa występowała praktycznie we wszystkich regionach Europy – zachodniej, środkowej, południowej, północnej i wschodniej. Obszar występowania obejmował tereny przybrzeżne zachodniej i południowej Francji, północne i środkowe Włochy, Austrię oraz Niemcy, rozciągając się dalej na Polskę, Białoruś, Bułgarię, Chorwację, Czechy, Grecję, Węgry, Liechtenstein, Litwę, Czarnogórę, Macedonię Północną, Ukrainę, Rumunię, a także Kaukaz, Wołgę, Ussuri, Amur, Lipieck oraz obszary Petersburga w Rosji.
Poza Europą, gatunek odnotowano w różnych rejonach Azji – w Bangladeszu, Indiach, regionie Mandżurii w Chinach, Kazachstanie, Uzbekistanie, Korei Północnej i Południowej oraz Japonii. Jego zasięg obejmował także tereny sięgające od Timoru Wschodniego po kilka miejsc przybrzeżnych w regionach południowo-zachodniej, północno-zachodniej, północnej, wschodniej i południowo-wschodniej Australii.
W Afryce Równikowej populacje zaobserwowano w Botswanie, Burundi, Kamerunie, Czadzie, Ghanie, Malawi, Mozambiku, Rwandzie, Republice Południowej Afryki, Sudanie Południowym, Tanzanii, Togo, Ugandzie i Zambii.
Obecne występowanie
Obecnie Aldrovanda vesiculosa występuje sporadycznie w Europie. Zanotowano jej obecność w Bułgarii, Grecji, Macedonii Północnej, na Węgrzech, Litwie, w Polsce, Rumunii, a także w niektórych rejonach Rosji, takich jak Petersburg, Psków i Lipieck.
Obserwacje odnotowano również w Serbii oraz na Ukrainie. Poza Europą, gatunek występuje na Dalekim Wschodzie Rosji (okręg Primorje), w północnej oraz południowo-wschodniej Australii, a także w Chinach, Zambii, Botswanie, Ugandzie i Południowej Afryce.
Wprowadzenia gatunku
Warto dodać, że Aldrovanda vesiculosa została pomyślnie wprowadzona do Szwajcarii, Holandii oraz USA. Ponadto, w latach 1995–2009 gatunek został ponownie wprowadzony do Republiki Czeskiej, zasiedlając kilka potencjalnie odpowiednich miejsc w południowych Czechach, zwłaszcza w kotlinie Trebon. p
Austria
- Jezioro Bodeńskie (okolice Bregencji): Dwie lokalizacje na torfowych terenach zalewowych, odnotowane w 1834, 1861, 1863 i 1865 – obecnie wymarłe
- Południowy Tyrol: Dwa miejsca w rejonie wschodnim od Innsbrucka, gdzie wśród trzcin obserwowano rozkwit i owocowanie (1851 i 1909) – obecnie brak potwierdzonych doniesień.
Białoruś
Lokalizacje niezweryfikowane:
- Siedem stanowisk w guberni witebskiej – rejestracje z 1862 i 1897.
- Czternaście stanowisk na bagnach dorzecza Prypeci, rozciągających się od okolic Mozyrza do obwodu brzeskiego – odkryte w 1897, potwierdzone w latach 50. XX w., obecnie niezweryfikowane.
- Jedno stanowisko w okolicach Grodna, przy granicy z Polską i Litwą (Herbarium WU).
Bułgaria
Obecne stanowiska:
- Bagna Dragoman, Zenpole: Populacja odkryta w 1928, wyginęła po osuszeniu w 1960, lecz została przywrócona dzięki reintrodukcji roślin z rejonów rumuńskich (Balkani Wildlife Society; Bulgarian Flora Online)
- Jezioro Srebarna: Lokalizacja w rezerwacie przyrody – pierwsze potwierdzenie w 2009 (Balkani Wildlife Society; Bulgarian Flora Online).
Chorwacja
Jedno stanowisko:
- Lokalizacja wzdłuż brzegów rzeki w pobliżu Slavonskiego Brodu, na granicy z Bośnią i Hercegowiną – niezweryfikowane od 1915 (Herbarium WU).
Czarnogóra
Stanowisko:
- Doniesienia o populacji w Parku Narodowym Jeziora Szkoderskiego – lokalizacja niezweryfikowana.
Czechy
Stanowiska historyczne i reintrodukowane:
- Stawy rybne Loucke (powiat karwiński): Obserwacje z 1952 roku, lokalizacja wymarła po intensywnym wydobyciu węgla.
- Reintrodukcja: W latach 1995–2009 rośliny wprowadzono do południowych Czech, a w 2018 roku w kotlinie Trzebońskiej zarejestrowano dwie stabilne populacje (ok. 2 000–50 000 roślin;).
Francja
Stanowiska wymarłe:
- Region Maillé (okolice Fontenay le Comte):** Liczne doniesienia od XVIII do XX wieku (1753–1969) – obecnie wymarłe (Inventaire national du Patrimoine naturel).
- Obszar Reserve Naturelle du Courant d’Huchet (jezioro Leon): Obserwacje z lat 1930–1934 – obecnie brak.
- Jezioro Noir (okolice Menacou), Mouries (Park Narodowy Mercantour),
- tereny wokół Lacanau, Hourtin, jezior Hardy, Le Porge, Bassin D’Archachon
- oraz inne lokalizacje: Wszystkie zarejestrowane doniesienia wskazują na wyginięcie populacji w tych rejonach
Grecja
Stanowisko istniejące:
- Jezioro Prespa: Duży zbiornik w północnej Grecji (rozciągający się także na Albanię i Macedonię Północną). Pierwsze doniesienia ok. 1981 roku, a populacja została ponownie odkryta w 2011 i potwierdzona w 2017.
Litwa
Stanowiska:
- Obszar Birdeksniai: Lokalizacja w licznych zatokach i bagiennych liniach brzegowych między jeziorami Ruzas i Zilmas – odkryta w 2001, potwierdzona w 2002.
- Okolice Wilna: Odkrycie z 1906 roku – obecnie wymarłe
- Jezioro Dysnai: Odkryte w 1955 roku, obecnie brak doniesień.
- Wzmianka o obserwacjach już z 1821 roku.
Macedonia Północna
Stanowisko istniejące:
- Odkrycie czterech mikrostanowisk od 2016 r. w północno-wschodniej części jeziora Prespa,
- z kolejną weryfikacją pięciu mikrostanowisk w 2018 r., wskazujących na populację liczącą dziesiątki tysięcy roślin. Rośliny utrzymywane są ex situ w Instytucie Botaniki w Trebon
Niemcy
Stanowiska wymarłe (21 lokalizacji w sześciu regionach
- Obszary nad Jeziorem Bodeńskim (okolice Lindau), wokół Angermünde, Ziethen, Hohenfinow, Zeuthensee, Rheinsberg, Mühlweiher, w rejonach Brandenburgii, w pobliżu Ruhland, Schlenkenstrasse, Parsteiner See, Grosser Plagesee, jezioro Hegesee, oraz inne lokalizacje przy rzekach.
Polska
Obecne i wymarłe miejsca (łącznie 12 istniejących i 75 wymarłych):
- Pojezierze Międzychodzko-Sierakowskie: Trzy stanowiska, z czego tylko jedno przetrwało reintrodukcję z 2005 roku; pozostałe wyginęły w drugiej połowie XX wieku.
- Pojezierze Augustowskie:** Trzynaście stanowisk – cztery naturalnie istniejące populacje w jeziorach Orle, Miklaszówek, Augustowskim i Kruglak; inne wymarły.
- Pojezierze Leszno-Włodawskie (Rezerwat Biosfery Polesie Zachodnie): 44 lokalizacje, z czego przetrwało osiem (Kaminski 2006; Kaminski 2010).
- Górne dorzecze Odry: 13 stanowisk – liczne obserwacje od 1851 do 1941; wszystkie wymarły z powodu industrializacji i intensyfikacji rolnictwa, ostatnie miejsce (torfowy staw Nowa Kuźnia koło Opola) potwierdzone w 1983, wyginęło w 1994
- Dolina górnej Wisły: Trzy populacje, obserwowane sporadycznie w latach 1862–1967, obecnie wymarłe (Kaminski 2006).
- Stawy u ujścia rzeki San: Trzy stanowiska, zarejestrowane w latach 1930., obecnie wyginęły
- Obszar Ostrowa i Słupcy: Osiem lokalizacji, obserwowanych w okresie 1882–1971 – wszystkie wymarłe.
Rosja
Zróżnicowany status – 6 istniejących oraz 37 niezweryfikowanych lokalizacji w dziewięciu regionach:
- Jezioro Mokhovo’e (rezerwat Galich’a Gora, ok. 25 km na południe od Lipiecka): Duża populacja (ponad 100 tys. roślin) zarejestrowana w połowie lat 90., potwierdzona w 2003 r.;
- kolejne stanowisko odkryte około 2013, które w 2017 roku okazało się suche Dodatkowo cztery lokalizacje w dorzeczu rzeki Woroneż (lata 60.) pozostają niezweryfikowane.
- Jezioro Ładoga: Rozległe stanowisko na wschód od Petersburga – największe i najbardziej stabilne miejsce występowania gatunku na świecie (populacja szacowana na miliony), choć z regularnymi wahaniami; potwierdzane obserwacje od lat 1953, z nową lokalizacją niedawno odkrytą niedaleko wsi Kukkorevo
- Delta Wołgi (rezerwat Astrachań): Kilka dużych populacji, rejestrowanych od lat 60., niezweryfikowanych od badań z lat 1990–1996 (Anon 1968; Caspian Environment Programme).
- Jezioro Mały Orłowski (obwód wołgogradzki): Niezweryfikowane od 1993 (Aranzadi Zientzi Elkartea).
- Obszar jeziora Chanka (przy granicy z Chinami i ujściu rzeki Ussuri): Sześć stanowisk – niedatowane, niezweryfikowane; jednak w 2018 r. potwierdzono obfite stanowisko przy mieście Chasan, a kolejne odkryto w 2019 r.
- Dodatkowo lokalizacja w rezerwacie Sikhote-Alinskii niedaleko Terney.
- Jeziora i starorzecza wzdłuż rzeki Amur (na północ od Chabarowska): Cztery stanowiska, opisane już w 1897 r., nieobserwowane od końca lat 50.
- Region Kaukazu: Co najmniej dziewięć populacji w jeziorach i bagnach, od Morza Kaspijskiego do obszarów przybrzeżnych Krasnodaru – większość lokalizacji niedatowana, wymagająca weryfikacji
- Dwa stanowiska wzdłuż rzeki w pobliżu Rostowa (niezweryfikowane).
- Siedem stanowisk na zachodnich bagnach przy granicy z Białorusią (niezweryfikowane; nowe lokalizacje odnotowane od 2005 r. w jeziorach Berezvica i Dolgo’e, potwierdzane przez ex situ w Instytucie Botaniki w Trebon).
- Wyspa Kronsztad w Zatoce Fińskiej – niezweryfikowana od 1907 r., prawdopodobnie wymarła.
Rumunia
Stanowiska (1 istniejące i 16 niezweryfikowanych):
- Delta Dunaju (okolice Tulczy): Cztery stanowiska, odnotowane w 1923 i 1961 – niezweryfikowane od 1995; nowsze zapisy z terenów podmokłych (1998, 2008) oraz rośliny utrzymywane ex situ w Instytucie Botaniki w Trebon
- Jezioro na północ od Oltenity (okolice Mangalii): Niezweryfikowane od 1965 (Herbarium WU).
- Bagna i rzeka w pobliżu Snagov: Sześć stanowisk – niezweryfikowane od 1906.
- Lokalizacje w pobliżu Oradei, na bagnach Kaplony/Szatmárnémeti, w rejonie Parku Narodowego Koros-Maros, przy Braszowie (Karpaty) oraz w okolicach Craiova: Wszystkie niezweryfikowane od lat 1906–1961.
Serbia
Stanowiska wymarłe (9 lokalizacji w pięciu regionach):
- Specjalny Rezerwat Przyrody Zasavica: Miejsce odkryte w 2005 r., potwierdzone w 2008 r., z późniejszymi doniesieniami o wyginięciu
- Dwie lokalizacje w pobliżu Jurišić – zarejestrowane w 1889 i 1896, obecnie wymarłe.
- Stanowisko w pobliżu Kupinova (Specjalny Rezerwat Przyrody Obedska bara) – odkryte w 1915, ostatnia obserwacja w 1977, obecnie wygasłe.
- Lokalizacja wzdłuż Dunaju w pobliżu Nowego Sadu – ostatnia obserwacja w 1982 r.
- Trzy lokalizacje w pobliżu Obrenovaca wzdłuż rzeki Sava oraz jedno w rzece Dunaj w pobliżu Makiš (Belgrad) – wszystkie wymarłe (Kaminski 2006; Protection and Management of Zasavica Special Nature Reserve 2011).
Słowacja
Jedno stanowisko wymarłe:
- Jezioro Zielone (Zelene) w pobliżu Vojki: Populacja wyginęła po wyschnięciu i zasypaniu w 1984 r.
Turcja
Stanowisko niezweryfikowane:
- Lokalizacja na północnym obszarze kraju – niedatowana, niezweryfikowana.
Węgry
Populacje o zróżnicowanym statusie:
- Jezioro Balata (powiat Somogy): Dwie duże populacje – początkowo odkryte w 1924, potwierdzone jako bardzo liczne w 1997, następnie spadek w 2003, odrodzenie po przywróceniu poziomu wody w 2010, a w 2019 roku potwierdzono populację liczącą kilka tysięcy roślin
- Pozostałe stanowiska: Lokalizacje na opuszczonych pastwiskach w pobliżu Pocsaj, przy Füzesgyarmat (odnotowane w 1859 i 1881, wymarłe w 1907) oraz przy Simonka Béla (od 1873, wymarłe od 1924).
Ukraina
Lokalizacje zróżnicowane (18 istniejących, 8 niezweryfikowanych, 13 wymarłych) w pięciu regionach:
- Dorzecze Prypeci: Co najmniej 30 stanowisk, rozciągających się od obszarów przy Kijowie przez okolice Kormy do Szacka. Część z nich (13) wymarła, natomiast siedemnaście przetrwało w rejonie Rezerwatu Biosfery Szatskiego
- Dwa stanowiska w pobliżu Czernihowa – niezweryfikowane od 1961 r.
- Lokalizacja w pobliżu Perejasław-Chmielnyzkyj – niezweryfikowana od 1961 r.
- Stanowisko w jeziorze niedaleko Charkowa – niezweryfikowane od 1987 r.
- Trzy stanowiska przy ujściu Dunaju na granicy z Rumunią – niezweryfikowane od 1993 r.
- Obszar zbiornika Dniepr – niedatowane i niezweryfikowane.
- Jezioro Kardashyns’kyi Lyman: Odkryte w 2001 r. w rozległej delcie Dniepru, w pobliżu Chersonia.
- Lokalizacja na obszarze jeziora Rogozy, na wydmach Olleshky w delcie Dniepru (obwód chersoński) – niezweryfikowana od 1976 r. (Herbarium Kijów).
Włochy
Wymarłe lokalizacje (19 stanowisk w siedmiu regionach):
- Obszary wokół jezior Mantua i mokradeł Ostiglia, Bolzano, rzeki Adyga, Salorno, Ivrei, jeziora Candia, fos, obszarów przy Mont Ventoux, w Akwitanii, Marsylii, Langwedocji-Roussillon, Orange, oraz w rejonie Bolonii:
- Liczne historyczne doniesienia wskazują na wyginięcie populacji w większości z tych miejsc (dane z lat 18.–20. wieku);specjalny zestaw kolekcji: W regionie Bolonii (1747 r.) – uznawany za typowy dla występowania gatunku. (1858, 1859).
Zagrożenia
Przegląd zagrożeń dla roślin mięsożernych wskazuje, że Aldrovanda vesiculosa jest narażona przede wszystkim na zabudowę mieszkaniową i handlową, rolnictwo, akwakulturę, modyfikacje naturalnych systemów oraz zanieczyszczenia. Komisja UE (2009) dodatkowo wymienia zakwaszenie, kanalizację, odmulanie, drenaż, eutrofizację, wycinkę lasów, wydobywanie żwiru, górnictwo, modyfikacje hydrologiczne oraz ograniczoną dyspersję. Obecnie główne zagrożenia to eutrofizacja i spadek poziomu wody spowodowane ociepleniem klimatu oraz suszą (Adamec, 2018). Dodatkowo istnieją obawy o nielegalny handel, a degradacja siedlisk dotyka niemal całego zasięgu gatunku – nawet w rezerwatach przyrody niewiele stanowisk pozostaje nietkniętych.
Użytkowanie i handel w szczegółach
Handel tym gatunkiem jest ograniczony, głównie w Europie.

10. Jarząb sudecki. Majovskya sudetica. Pyrus sudetica. (Sorbus sudetica)
Sorbus sudetica został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2016 r. Sorbus sudetica jest wymieniony jako gatunek zagrożony
Jarząb sudecki (Majovskya sudetica) to endemiczny gatunek drzewa z rodziny różowatych (Rosaceae). W szerszym ujęciu systematycznym bywa klasyfikowany jako Sorbus sudetica (Tausch) Fritsch. Występuje naturalnie w Karkonoszach na terenie Polski i Czech.
opis
Jest to niewielkie drzewo lub krzew, osiągające wysokość do kilku metrów. Posiada charakterystyczne liście – pierzasto złożone, o eliptycznych listkach, z piłkowanym brzegiem. Jesienią liście przebarwiają się na żółto i pomarańczowo. Kwiaty są białe, drobne, zebrane w baldachogrona, a owoce mają kulisty kształt i czerwoną barwę, przypominającą inne jarzębiny.
populacja
Występuje około 100 dojrzałych osobników rozmieszczonych w dwóch subpopulacjach obejmujących dziesięć lokalizacji. Najbardziej oddalone lokalizacje dzieli 14 km. Dwie z nich liczą kilkadziesiąt osobników, podczas gdy pozostałe zawierają jedynie pojedyncze egzemplarze (Businský, 2009). Populacja zmniejszyła się z około 150 do 100 osobników.
zasięg geograficzny
Gatunek ten jest endemiczny dla Karkonoszy w Republice Czeskiej. Historycznie odnotowano jego występowanie w Polsce na podstawie okazów zielnikowych (Kovanda, 1998), jednak obecnie uznaje się go za wymarły na tym obszarze. Preferuje wysokości od 1050 do 1350 m n.p.m. (Businský, 2009). Szacowany obszar jego występowania wynosi około 20 km².
habitat i ekologia
Sorbus sudetica to krzew zasiedlający zbiorowiska trawiaste oraz zbocza, gdzie nie występuje konkurencja ze strony świerka pospolitego.
zagrożenia
Businský (2009) wspomina o „globalnych zagrożeniach środowiskowych”, a także o wewnętrznym ryzyku tak małej populacji, jako o głównych zagrożeniach dla tego gatunku. Należą do nich zacienianie przez świerk pospolity (Picea abies), sosnę górską (Pinus mugo) i jarząb pospolity (Sorbus aucuparia). Zagrożenie stanowią również żerowanie jeleni, a także zdarzenia losowe, takie jak spadanie klifów lub lawiny.

11. Krótkoszek aksamitny. (Brachytheciastrum vanekii)
Gatunek Brachytheciastrum vanekii został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2016 r. Brachytheciastrum vanekii znajduje się na liście gatunków zagrożonych.
zasięg geograficzny
Ten europejski gatunek endemiczny jest znany tylko z niewielkiej części Polski i Słowacji, gdzie występuje wyłącznie w Tatrach Wysokich. Zidentyfikowano dziesięć stanowisk, z których dwa już zniknęły. Szacunkowy zakres występowania (EOO) wynosi 350 km², podczas gdy obecny obszar występowania (AOO) to zaledwie 32 km². Gatunek ten rośnie na wysokościach od 1600 m do 2400 m n.p.m.
populacja
Gatunek ten zanika, a niektóre lokalizacje, takie jak wodospad Skok i szczyt Osterva, nie zostały potwierdzone. Długość pokolenia szacuje się na około 15 lat, co jest zbliżone do pokolenia blisko spokrewnionego gatunku B. velutinum. W ciągu ostatnich 30 lat populacja mogła zmniejszyć się o 20%, ponieważ dwie z dziesięciu znanych subpopulacji wyginęły. Dokładna liczebność populacji pozostaje nieznana i wymaga dalszych badań. Subpopulacje są małe i silnie odizolowane, występując w różnych dolinach, co znacznie utrudnia ich ponowną kolonizację. W konsekwencji populacja jest uważana za poważnie rozdrobnioną.
siedlisko i ekologia
Gatunek ten preferuje mylonity – skały metamorficzne, które powstały w wyniku plastycznej deformacji pierwotnej skały (protolitu) pod wpływem silnych nacisków i przesunięć, powodujących jej ścinające odkształcenie. W praktyce oznacza to, że oryginalna skała została przekształcona w wyniku intensywnych ruchów tektonicznych, co nadało jej charakterystyczną strukturę. Oprócz mylonitów, gatunek ten występuje także na gruzach oraz na terenach porośniętych trawą.
zagrożenie
Turystyka stanowi główne zagrożenie dla tego gatunku. Presja turystyczna prawdopodobnie przyczyniła się do zaniku populacji na dwóch lokalizacjach – przy wodospadzie Skok i szczycie Osterva. Jednak subpopulacje znajdujące się w Parku Narodowym Tatr Wysokich korzystają z pewnej ochrony przed negatywnymi skutkami turystyki.

12. Nees’ Hornwort (Anthoceros neesii)
Gatunek rogaty Neesa Anthoceros neesii został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2016 r. Anthoceros neesii znajduje się na liście gatunków zagrożonych.
opis:
Gatunek ten wyróżnia się małym, rozetkowatym, płaskim i płożącym plechem o średnicy zwykle 5–7 mm (maksymalnie do 12 mm). Plecha ma ciemnozieloną barwę, nieregularnie pofalowane brzegi i jest gruba na 6–10 warstw komórek w części środkowej, stopniowo przechodząc w cieńszą, 2–3-warstwową strukturę na obrzeżach. W jej wnętrzu znajdują się małe kolonie sinic z rodzaju Nostoc Vaucher ex Bornet & Flahault.
Gatunek ten jest jednokomórkowy i posiada w każdej jamie 2–6 maczugowatych anteridiów. Okrywy występują w pobliżu brzegów plechy, często w parach, i podtrzymują torebki, które leżą na plechu i wystają poza jego krawędź. Torebki mierzą około 1 mm długości, mają podłużno-jajowaty kształt i zredukowaną lub nieobecną kolumnę. Pseudoelatery są jednokomórkowe.
Zarodniki mają barwę od złocistożółtej do żółtozielonej i średnicę 35–45 µm. Ich powierzchnia jest delikatnie pokryta drobnymi strukturami przypominającymi robakowate wzory, a zarówno strona proksymalna, jak i dystalna wydają się niemal gładkie (ryc. 3J−L). Pod względem rozmiaru i rzeźby przypominają zarodniki Phaeoceros carolinianus, u których powierzchnia proksymalna jest prawie gładka, natomiast dystalna ma drobne kolce lub brodawki.
populacja
Europejska (i światowa) populacja tego jednorocznego gatunku jest ograniczona do zaledwie kilku lokalizacji w trzech lub czterech krajach, przy czym jego status w Polsce pozostaje niepewny. Gatunek ten tworzy gametofity składające się z dziesiątek, rzadziej setek pojedynczych plech, pojawiających się od połowy lata do jesieni.
Mimo intensywnych badań terenowych w ostatnich dekadach nowe stanowiska znajdowano jedynie w pobliżu znanych lokalizacji lub w obrębie dotychczasowego zasięgu występowania. Populacja składa się z co najmniej siedmiu izolowanych subpopulacji, między którymi nie dochodzi do wymiany genetycznej (nie licząc niepotwierdzonych wystąpień w Polsce). Gatunek ten wykazuje silne rozdrobnienie populacyjne, wynikające z ograniczonej zdolności do rozmnażania i dyspersji – zapłodnienie, jak u wszystkich mszaków, zachodzi na niewielkie odległości, a duże zarodniki osadzają się blisko powierzchni gleby, co utrudnia ich rozprzestrzenianie.
Z uwagi na izolację subpopulacji oraz ich niewielką liczebność, istnieje wysokie ryzyko lokalnych wymierań przy niskim prawdopodobieństwie rekolonizacji. Szacuje się, że globalna populacja liczy mniej niż 5000 osobników-ekwiwalentów, a każda subpopulacja nie przekracza 1000 osobników-ekwiwalentów. Przyjęto, że jeden osobnik-ekwiwalent to jeden metr kwadratowy powierzchni, na której występuje gatunek.
Obecny trend populacyjny pozostaje nieznany, jednak przewiduje się, że w ciągu najbliższej dekady może nastąpić redukcja populacji o 25%, jeśli intensyfikacja gospodarki rolnej będzie postępować, a pozostałe tradycyjnie użytkowane pola – kluczowe dla przetrwania gatunku – znikną.
siedlisko i ekologia
Gatunek ten występuje wyłącznie w siedliskach antropogenicznych, głównie na polach uprawnych objętych regularnym użytkowaniem rolniczym. Jego naturalne siedlisko pozostaje nieznane. Jest to roślina jednoroczna, której gametofity pojawiają się od połowy lata do jesieni, głównie na polach zbóż i ścierniskach. Ze względu na słabą konkurencyjność często ustępuje innym gatunkom mchów.
Preferuje lekko kwaśne gleby gliniasto-piaszczyste, gdzie rośnie wraz z innymi rzadkimi przedstawicielami rogatków, takimi jak Notothylas orbicularis, oraz charakterystycznymi roślinami pól uprawnych regularnie poddawanych orce. Istnieją dowody, że zarodniki tego gatunku mogą przetrwać w glebie przez kilka lat, umożliwiając mu przetrwanie okresów niekorzystnych warunków uprawowych.
zagrożenia
Podobnie jak inne gatunki związane z siedliskami uprawnymi, ten rogacz jest silnie uzależniony od tradycyjnych metod zarządzania rolniczego i regularnych zakłóceń. Jego populacja jest zagrożona przez intensyfikację rolnictwa, co prowadzi do stałego spadku powierzchni i jakości dostępnych siedlisk. Główne zagrożenia obejmują ograniczenie upraw zbóż oraz praktykę orki bezpośrednio po zbiorach, która uniemożliwia roślinie ukończenie rocznego cyklu życiowego.
Dodatkowym czynnikiem negatywnym jest przekształcanie pól uprawnych w użytki zielone, co prowadzi do dalszej utraty siedlisk. Intensywne stosowanie nawozów i herbicydów oraz ciężkie praktyki zarządzania mechanicznego dodatkowo przyczyniają się do
degradacji warunków wzrostu; Wprowadzenie upraw pośrednich w celu ograniczenia wycieku azotanów w niektórych krajach również negatywnie wpłynęło na rozwój gatunku. Jeśli intensywne zarządzanie polami będzie kontynuowane, przewiduje się znaczący spadek populacji w ciągu najbliższej dekady.