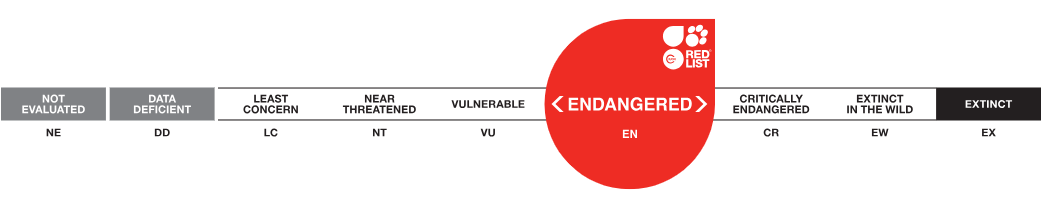
Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Owady, Grzyby, Małże, Ślimaki. Stan na 15 marca 2025 r.
Zagrożona bioróżnorodność, zagrożone życie Europy i Świata. Część. 3
Znaczenie owadów dla środowiska i człowieka
Owady są kluczowymi elementami ekosystemów, odgrywając fundamentalną rolę zarówno w środowisku, jak i dla człowieka. Pełnią funkcje zapylaczy, co jest niezbędne dla upraw rolnych i utrzymania bioróżnorodności roślin. Dzięki zapylaniu, wiele gatunków roślin może się rozmnażać, co bezpośrednio wpływa na produkcję żywności i stabilność ekosystemów rolniczych.
Ponadto, owady przyczyniają się do rozkładu materii organicznej, wspomagając recykling składników odżywczych w glebie. Działalność tych organizmów pomaga utrzymać zdrowie ekosystemów, poprawiając strukturę i żyzność gleby, co z kolei wspiera wzrost roślin.
Owady są również podstawą łańcuchów pokarmowych – stanowią pokarm dla wielu gatunków ptaków, ssaków, płazów i ryb, co przekłada się na stabilność i różnorodność biologiczną całych ekosystemów. Dodatkowo, naturalni wrogowie owadów, tacy jak drapieżne owady czy ptaki, pomagają kontrolować populacje szkodników, zmniejszając tym samym potrzebę stosowania chemicznych pestycydów, co ma pozytywny wpływ na zdrowie ludzi oraz środowisko.
Znaczenie owadów wykracza także poza aspekty ekologiczne – mają one ogromne znaczenie gospodarcze. Są wykorzystywane w badaniach naukowych, stanowią inspirację dla nowych technologii (biomimikra) oraz są źródłem cennych produktów, takich jak miód i wosk. Ich obecność i różnorodność są wskaźnikiem zdrowia środowiska, dlatego monitorowanie ich populacji jest istotne dla oceny wpływu zmian klimatycznych oraz działalności człowieka na przyrodę.
Chociaż wiele owadów jest klasyfikowanych jako gatunki o najmniejszym ryzyku (LC), to zmiany środowiskowe, zanieczyszczenia i intensywna działalność człowieka mogą wpływać na ich populacje. Dlatego ochrona owadów jest kluczowa nie tylko dla zachowania bioróżnorodności, ale także dla zapewnienia równowagi ekologicznej i dobrobytu ludzkiego.
Znaczenie grzybów dla środowiska i człowieka
Grzyby pełnią kluczową rolę w ekosystemach, wpływając na obieg materii, zdrowie gleby i funkcjonowanie innych organizmów. Jednak wiele gatunków grzybów jest zagrożonych wskutek zmian środowiskowych, zanieczyszczeń oraz działalności człowieka. Ich ochrona ma istotne znaczenie zarówno dla przyrody, jak i dla ludzi.
Znaczenie dla środowiska
Degradacja materii organicznej
Grzyby rozkładają martwe rośliny i zwierzęta, przekształcając je w składniki odżywcze dostępne dla innych organizmów. Ich zanikanie może prowadzić do zaburzeń w obiegu pierwiastków, szczególnie w ekosystemach leśnych.Symbioza z roślinami (mikoryza)
Wiele gatunków grzybów współżyje z roślinami, dostarczając im składników odżywczych i zwiększając ich odporność na suszę oraz choroby. Spadek liczby grzybów mikoryzowych może negatywnie wpłynąć na lasy i ekosystemy trawiaste.Wsparcie dla bioróżnorodności
Grzyby stanowią podstawę sieci troficznych – od nich zależy przetrwanie wielu organizmów, w tym owadów, ssaków i ptaków, które żywią się ich owocnikami lub wykorzystują je jako siedliska.
Znaczenie dla człowieka
Źródło pożywienia i leków
Niektóre zagrożone grzyby są jadalne lub wykorzystywane w medycynie. Przykładem są gatunki o właściwościach antybiotycznych czy przeciwnowotworowych. Ich wyginięcie oznacza utratę potencjalnych źródeł nowych leków.Wsparcie dla rolnictwa i leśnictwa
Zdrowe populacje grzybów mikoryzowych poprawiają jakość gleby i wzrost roślin, co ma kluczowe znaczenie dla rolnictwa ekologicznego i gospodarki leśnej.Walory kulturowe i estetyczne
Grzyby od wieków są obecne w kulturze ludowej, sztuce i kuchni. Niektóre gatunki mają unikalne kształty i barwy, przyczyniając się do piękna krajobrazu.
Zagrożenia i ochrona
Główne zagrożenia dla grzybów to wylesianie, zanieczyszczenia chemiczne, zmiany klimatu i nadmierne zbieranie. Ochrona zagrożonych gatunków wymaga monitoringu ich populacji, zachowania naturalnych siedlisk oraz edukacji społeczeństwa na temat ich roli w ekosystemie.
Znaczenie małży dla środowiska i człowieka
Małże odgrywają kluczową rolę w ekosystemach wodnych oraz mają znaczące korzyści dla człowieka. Dla środowiska działają jako naturalne filtry, oczyszczając wodę z nadmiaru cząstek organicznych, bakterii i zanieczyszczeń, co poprawia jej jakość i przejrzystość. Dzięki temu pomagają w utrzymaniu równowagi biologicznej, regulując cykle biogeochemiczne oraz wspierając zdrowie całego ekosystemu wodnego. Małże są również uważane za wskaźniki stanu środowiska, co pozwala na monitorowanie zmian w jakości wody i oceny wpływu działań antropogenicznych.
Dla człowieka małże mają duże znaczenie ekonomiczne i kulturowe. Stanowią źródło pożywienia, są ważnym elementem akwakultury oraz tradycyjnych kuchni wielu regionów. W niektórych kulturach cenione są także za zdolność do produkcji pereł i innych cennych surowców. Ich obecność i zdrowe populacje są wskaźnikiem czystych i stabilnych ekosystemów wodnych, co ma bezpośredni wpływ na jakość życia społeczności korzystających z tych wód.
Podsumowując, małże pełnią istotną rolę w filtracji i oczyszczaniu wód, wspierając bioróżnorodność oraz stabilność ekosystemów, a jednocześnie stanowią ważne źródło pożywienia i dochodu dla ludzi, co czyni je niezwykle cennymi zarówno dla środowiska, jak i dla człowieka.
Znaczenie ślimaków dla środowiska i człowieka
Ślimaki odgrywają istotną rolę w ekosystemach, pełniąc funkcje rozkładających materię organiczną i przyczyniając się do recyklingu składników odżywczych w glebie. Rozkładając liście, resztki roślinne i inne substancje organiczne, wspierają procesy glebotwórcze, co wpływa na poprawę struktury gleby i jej żyzności. Są również ważnym źródłem pokarmu dla wielu zwierząt, takich jak ptaki, ssaki, gady i płazy, co czyni je kluczowym elementem łańcucha pokarmowego i wskaźnikiem zdrowia ekosystemu.
Dla człowieka ślimaki mają znaczenie zarówno ekonomiczne, jak i kulturowe. W wielu regionach świata stanowią element tradycyjnej kuchni, a hodowla ślimaków (escargot farming) dostarcza cennego źródła białka i dochodu. Ponadto, ślimacze wydzieliny, zwłaszcza śluz, znajdują zastosowanie w kosmetyce i medycynie ze względu na swoje właściwości regenerujące skórę i działanie przeciwzapalne. Ślimaki są także używane jako bioindykatory, co oznacza, że ich obecność i stan populacji mogą wskazywać na jakość środowiska oraz poziom zanieczyszczeń.
Ochrona ślimaków jest zatem kluczowa dla utrzymania równowagi ekologicznej, a ich monitorowanie pozwala lepiej zrozumieć wpływ działalności człowieka na środowisko.
Owady:
Bogatek wspaniały. (Buprestis splendens)
Cheilosia crassiseta
Cheilosia hercyniae
Cheilosia loewi
Cheilosia montana
Cheilosia nivalis
Cheilosia pini.
Corticeus versipellis
Idänvaskinen (Orthonevra plumbago)
Korosz dwubarwny. Korówka dwubarwna. (Corticeus bicoloroides)
Limburse Korsetzweefvlieg (Neoascia unifasciata)
Nakwiecień kniejak. Woudsapzweefvlieg (Brachyopa grunewaldensis)
Nakwiecień plamkoskrzydły. Foltosszárnyú Fanedvlégy (Brachyopa maculipennis)
Pihkakeilanen (Cheilosia morio)
Pilnicznik fiołkowy. Violet Click Beetle (Limoniscus violaceus).
Ritka Aranyhasúlégy (Melanogaster curvistylus)
Shielded Agabus Beetle (Agabus clypealis)
Sichrawa karpacka. (Pseudogaurotina excellens)
Vit Örtblomfluga (Cheilosia alba)
Węglarek klonowy (Ropalopus ungaricus)
Grzyby:
Cystoderma carpaticum
Jamkóweczka cytrynowa. Lemon-coloured Antrodiella (Flaviporus citrinellus)
Pniarek lekarski. Agarikon. Eburiko (Fomitopsis officinalis)
Wilgotnica żółta. Dottergelber Saftling. (Gloioxanthomyces vitellinus)
Małże:
Perłoródka rzeczna. Freshwater Pearl Mussel (Margaritifera margaritifera)
Skójka gruboskorupowa. Thick Shelled River Mussel. (Unio crassus)
Szczeżuja spłaszczona. Depressed River Mussel (Pseudanodonta complanata)
Unio nanus
Ślimaki:
Źródlarka żywiecka (Bythinella zyvionteki)
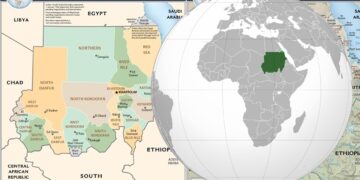
Krytycznie zagrożone gatunki występujące w Polsce (CR) zawiera 11 gatunków owadów (20), grzybów (4), małży (4), ślimaków (1)
Owady.

1. Bogatek wspaniały. (Buprestis splendens)
Gatunek Buprestis splendens został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2009 r. Buprestis splendens znajduje się na liście gatunków zagrożonych.
Gatunek ten jest wyjątkowo rzadki w całym swoim zasięgu i powszechnie uznawany za symbol ochrony owadów. Jest reliktem lasów pierwotnych, co oznacza, że jego występowanie jest ściśle związane z naturalnymi, nieprzekształconymi ekosystemami leśnymi. W Polsce ostatnie potwierdzone obserwacje pochodzą wyłącznie z Puszczy Białowieskiej. Gatunek ten podlega ochronie gatunkowej, co podkreśla jego wyjątkowe znaczenie w ekosystemach leśnych.
opis
Bogatek wspaniały (Buprestis splendens) to jeden z najpiękniejszych i najrzadszych chrząszczy Europy, należący do rodziny Buprestidae (Bogatkowate). Jego ciało jest wydłużone, spłaszczone i osiąga długość około 15–20 mm.
Chrząszcz wyróżnia się metalicznie błyszczącym ubarwieniem, które może mienić się różnymi odcieniami zieleni, złota i niebieskiego. Wzdłuż pokryw biegną charakterystyczne, ciemniejsze pasy o miedzianym lub fioletowym odcieniu. Głowa i przedplecze mają intensywnie zielonkawy połysk, a oczy są duże, czarne i wyraźnie kontrastują z resztą ciała.
Czułki są krótkie, nitkowate i nieznacznie zgrubiałe ku końcowi. Nogi smukłe, przystosowane do wspinaczki po korze drzew. Pokrywy skrzydłowe są twarde, lekko zwężające się ku tyłowi, co nadaje chrząszczowi aerodynamiczny kształt.
Jako przedstawiciel rzędu Coleoptera (Chrząszcze), gatunek ten posiada aparat gębowy typu gryzącego. Jest również typowym przedstawicielem gromady Insecta (Owady) oraz typu Arthropoda (Stawonogi), charakteryzując się segmentowaną budową ciała i chitynowym oskórkiem.
Bogatek wspaniały to przykład owada, którego wygląd nie tylko zachwyca, ale także podkreśla jego unikalność i znaczenie w ochronie przyrody.
zasięg geograficzny
Bogatek wspaniały (Buprestis splendens) to gatunek eurosyberyjski, którego zasięg obejmuje niemal całą Europę – od Hiszpanii, Włoch i Grecji na południu, po Szwecję i Karelię na północy. Występował także w Danii i Wielkiej Brytanii, jednak doniesienia te prawdopodobnie dotyczą błędnie oznaczonych okazów lub osobników zawleczonych wraz z drewnem amerykańskiego gatunku Buprestis aurulenta. Znaleziono go również w Finlandii, choć nie jest pewne, czy populacja tam występująca jest naturalna. Poza Europą jego obecność odnotowano w Chinach i Japonii, gdzie występuje podgatunek Buprestis splendens niponica. Możliwe, że gatunek zasiedla również Syberię, jednak brakuje na ten temat pewnych informacji.
W wielu krajach Europy bogatek wspaniały jest skrajnie rzadki, a większość zarejestrowanych stanowisk pochodzi sprzed kilkudziesięciu, a nawet ponad stu lat. W Polsce odnotowano go w XIX wieku w Toruniu oraz w latach 50. XX wieku w Wielkopolskim Parku Narodowym. Obecnie jedyne znane stanowisko znajduje się w Puszczy Białowieskiej, gdzie gatunek ten obserwowano od 1916 roku, a ostatnie potwierdzone doniesienia pochodzą z lat 90. XX wieku.
We Włoszech jego obecność stwierdzono w dwóch lokalizacjach w Apeninach, w regionie Basilicata. W Rumunii występuje na południowym zachodzie kraju, a w Hiszpanii znany jest z trzech stanowisk. Status populacji w Grecji pozostaje nieznany.
Dawniej gatunek występował także w Europie Środkowej oraz w leśnych obszarach Ukrainy, jednak od wielu dziesięcioleci brak nowych obserwacji. W Niemczech, Austrii i Szwecji uznaje się go za wymarłego. Bogatek wspaniały zasiedla zarówno niziny (od 100–200 m n.p.m.), jak i tereny górskie, sięgając do wysokości około 2000 m n.p.m.
populacja
Gatunek ten jest niezwykle rzadki w całym swoim europejskim zasięgu, a jego populacje są silnie rozdrobnione i maleją. Prawdopodobnie wymarł już na Ukrainie i w Hiszpanii, a w Niemczech, Austrii i Szwecji jego obecność nie jest już odnotowywana. Obecnie występuje jedynie w niewielkiej części swojego pierwotnego zasięgu, tworząc małe, izolowane populacje reliktowe.
Na Ukrainie gatunek jest skrajnie rzadki – ostatni okaz został tam odnotowany około 60 lat temu w pobliżu Kijowa. W Hiszpanii znane są jedynie trzy osobniki zebrane w ciągu ostatnich 50 lat. W Niemczech jedyny historyczny zapis pochodzi z Bawarii sprzed 1900 roku.
W Polsce odnotowano jeden niedawny przypadek występowania gatunku. Na Bałkanach dostępne informacje są ograniczone, a w Rumunii nowy okaz został zgłoszony w ostatnich latach w południowo-zachodnich Karpatach.
Habitat i ekologia
Gatunek ten występuje w pierwotnych lasach iglastych i mieszanych, zarówno w górach, jak i na niżu. Kluczowym warunkiem dla jego występowania jest obecność dużej ilości martwych drzew, co jest niezbędne dla jego rozwoju. Gatunek jest ściśle związany z drzewami iglastymi, głównie z sosną, choć szczegółowe dane dotyczące jego ekologii są ograniczone. Jego rozwój jest saproksyliczny, czyli obligatoryjnie związany z martwym i rozkładającym się drewnem. Występuje przede wszystkim w reliktowych lasach sosnowych, gdzie larwy rozwijają się w martwych pniach o dużej średnicy (powyżej 40 cm) oraz w wyższych partiach drzew. Dostęp do światła słonecznego stanowi kluczowy warunek, gdyż drzewa żywicielskie muszą być dobrze nasłonecznione. W Rumunii niedawno zgłoszono populację tego gatunku w reliktowym lesie sosny czarnej.
Zagrożenie
Zagrożenia i Ochrona Gatunku
Gatunek ten stoi w obliczu poważnych zagrożeń związanych z zanikiem pierwotnych lasów iglastych i mieszanych. Usuwanie martwych drzew, szczególnie iglastych, prowadzi do uszczuplania potencjalnej bazy rozwojowej, co ma negatywny wpływ na byt gatunku. Dodatkowo, brak przepływu genów między izolowanymi subpopulacjami o niskiej liczebności pogłębia problem ich rozdrobnienia. Nawet zwiększenie ilości martwego drewna w lesie może nie przynieść pożądanych efektów ze względu na izolację lokalnych populacji, zwłaszcza w Polsce.
Głównym zagrożeniem pozostaje komercyjna i nielegalna wycinka, która modyfikuje strukturę wiekową i zagęszczenie drzew. Niektóre subpopulacje, choć nie bezpośrednio narażone na wycinkę, cierpią z powodu powolnego odrostu, co czyni je szczególnie podatnymi na zdarzenia takie jak pożary. Ponadto, komercyjne zbieranie okazów dodatkowo zagraża pozostałym populacjom. W Rumunii zagrożenia są niejednoznaczne, jednak utrata populacji wydaje się być związana z usuwaniem martwych i obumierających drzew.
Ocena regionalna Unii Europejskiej klasyfikuje ten gatunek jako zagrożony, gdyż jego powierzchnia zajmowana (AOO) wynosi mniej niż 500 km², a siedlisko jest w fazie zaniku wskutek niekorzystnej gospodarki leśnej. Ten europejski endemit jest bardzo rzadki na całym swoim zasięgu, z izolowanymi populacjami, a w niektórych krajach istnieją podejrzenia, że może już być wymarły.
Aktualne Sposoby Ochrony
W Polsce gatunek ten podlega ochronie gatunkowej, a dwa znane stanowiska znajdują się na obszarach parków narodowych, m.in. w Parku Narodowym Białowieskim i Wielkopolskim. Jest również uwzględniony na liście gatunków ściśle chronionych w ramach Konwencji Berneńskiej (Appendix II) oraz w Dyrektywie Habitatowej UE (Annex II i IV), co obliguje do tworzenia obszarów specjalnej ochrony (OSO). W Polsce figuruje na „Czerwonej liście zwierząt gonących i zagrożonych” jako gatunek zagrożony. W Niemczech natomiast wpisany został na „czerwoną listę” jako gatunek wymarły, a na światowej Czerwonej liście zwierząt IUCN jest klasyfikowany jako gatunek o statusie podatnym na zagrożenie.
Proponowane Sposoby Ochrony
Aby skuteczniej chronić ten gatunek, konieczne jest poznanie roślin żywicielskich i szczegółowej biologii gatunku. Obecny stan wiedzy wskazuje na potrzebę zwiększenia ilości pozostawianego martwego drewna iglastego w lasach, zwłaszcza w rezerwatach i parkach narodowych, co może wspierać rozwój i utrzymanie populacji. Dodatkowo, konieczne są działania mające na celu ograniczenie komercyjnej i nielegalnej wycinki oraz promowanie zrównoważonej gospodarki leśnej, aby utrzymać ciągłość naturalnych siedlisk i zapewnić przepływ genów między izolowanymi subpopulacjami.

2. Cheilosia crassiseta
Cheilosia crassiseta została ostatnio oceniona pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia crassiseta znajduje się na liście gatunków zagrożonych.
opis
rozmiar:
Muchówka średniej wielkości, o długości ciała wynoszącej około 8–11 mm.
ubarwienie i budowa:
- Ciało masywne, krępe, pokryte gęstym owłosieniem.
- Głowa szeroka, oczy duże i lekko owłosione, niemal stykające się u samców.
- Czułki krótkie, ciemne, z wyraźnie pogrubionym trzecim członem.
- Tułów ciemnobrązowy do czarnego, matowy, z gęstym szarym owłosieniem.
- Odnóża czarne, mocne, tylne golenie lekko pogrubione.
- Skrzydła przezroczyste z lekko przydymionymi żyłkami, u nasady ciemniejsze.
- Odwłok szeroki, zwarty, czarny z metalicznym połyskiem, pokryty krótkimi, jasnymi włoskami.
Charakterystyczne cechy:
- Gęste, krótkie owłosienie na ciele.
- Pogrubione tylne golenie.
- Krępa budowa ciała.
zasięg geograficzny
Gatunek ten jest endemiczny dla górskich regionów Europy Środkowej i Południowo-Wschodniej. Jego występowanie jest mocno rozproszone, obejmując zarówno niższe, jak i wyższe partie gór w Polsce, Alpach (Francja, Szwajcaria, Austria, Włochy), na Słowacji, w Słowenii oraz na Bałkanach, w tym w Czarnogórze. Pomimo szerokiego zasięgu geograficznego, powierzchnia faktycznie zajmowanych siedlisk jest niewielka – szacuje się ją na 200 km² w Europie i 148 km² w krajach Unii Europejskiej.
populacja
Brak dokładnych danych na temat trendów populacji tego gatunku w Europie i Unii Europejskiej. Ze względu na jego występowanie w wysokogórskich siedliskach populacja jest prawdopodobnie silnie rozdrobniona, co wynika z izolacji poszczególnych subpopulacji w różnych pasmach górskich. Taka fragmentacja może ograniczać przepływ genów między populacjami, zwiększając ich podatność na lokalne wymieranie. Dodatkowo, specyficzne wymagania siedliskowe sprawiają, że gatunek jest szczególnie wrażliwy na zmiany środowiskowe, w tym ocieplenie klimatu i degradację naturalnych ekosysteSiedlisko i
Habitat i ekologia
Gatunek ten zasiedla otwarte tereny górskie, głównie naturalne, nieprzekształcone łąki o podłożu niewapiennym. Występuje na wysokościach od górnej granicy lasów jodłowo-świerkowych (Abies – jodła, Picea – świerk) aż po alpejskie łąki, sięgając nawet 2500 m n.p.m. Brakuje danych na temat aktywności dorosłych muchówek na kwiatach, co utrudnia określenie ich roślin pokarmowych. Okres lotu przypada na czerwiec, natomiast na większych wysokościach może trwać do lipca. Cykl rozwojowy tego gatunku nie jest dokładnie poznany – roślina żywicielska larw oraz ich etapy rozwoju pozostają nieznane.
Zagrożenia
Gatunek ten jest narażony na degradację siedlisk, głównie z powodu intensywnego wypasu bydła na górskich łąkach. Nadmierny wypas prowadzi do zubożenia roślinności, zmiany struktury siedlisk oraz zmniejszenia dostępności odpowiednich miejsc do rozwoju larw i bytowania dorosłych muchówek. W dłuższej perspektywie może to negatywnie wpłynąć na liczebność populacji i ograniczyć jej zasięg występowania.

3. Cheilosia hercyniae
Cheilosia hercyniae została ostatnio oceniona pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia hercyniae znajduje się na liście gatunków zagrożonych
opis
Cheilosia hercyniae to gatunek muchówki z rodziny Syrphidae, należący do podrodzaju Taeniochilosia, który wykazuje cechy wspólne z innymi przedstawicielami grupy gatunków Cheilosia caerulescens. Wyróżnia się kilkoma charakterystycznymi cechami, które pozwalają na jego odróżnienie od innych gatunków tej grupy.
Czułki: Samica Cheilosia hercyniae ma bardzo wyraźny, żółto-pomarańczowy trzeci segment czułka. Dodatkowo, na wewnętrznej powierzchni tego segmentu znajduje się prosty, szczelinowaty dołek czułkowy, który jest jednym z kluczowych elementów rozróżniających ten gatunek od spokrewnionych.
Mesanepisternit: Zarówno samiec, jak i samica Cheilosia hercyniae charakteryzują się bardzo specyficznym, tylno-grzbietowym trójkątnym przedłużeniem mesanepisternitu 1, które jest pokryte długimi włoskami. Ta cecha stanowi dodatkową cechę wyróżniającą ten gatunek w porównaniu do innych przedstawicieli grupy caerulescens.
Wszystkie te cechy pomagają w identyfikacji Cheilosia hercyniae, umożliwiając odróżnienie go od innych gatunków o podobnym wyglądzie.
zasięg geograficzny
Gatunek ten ma szeroki zasięg występowania w Europie Środkowej, obejmujący zarówno regiony górskie, jak i nizinne. Został odnotowany w wielu krajach, takich jak Czechy, Polska, Francja, Szwajcaria, Niemcy, Austria, północne Włochy, Hiszpania, Czarnogóra i Rumunia. W Polsce występuje m.in. w Tatrach, a w Czechach zarejestrowany jest głównie w rejonach górskich. W Hiszpanii oraz na Półwyspie Bałkańskim w Czarnogórze i Rumunii, gatunek również jest obecny, ale jego populacje są stosunkowo nieliczne i rozproszone.
Najbardziej wysunięty na północ zapis pochodzi ze Szwecji, z regionu Uppland, gdzie w 2005 roku odnotowano dwa okazy. Niestety, brak jest późniejszych obserwacji z tego kraju, co sprawia, że obecność gatunku w Szwecji jest uznawana za niepewną.
Gatunek ten ma dość szeroki zasięg występowania (EOO – Extent of Occurrence), ale jego obszar zajmowany (AOO – Area of Occupancy) jest stosunkowo mały. W Europie obszar ten wynosi tylko 120 km², a w Unii Europejskiej – 96 km². Mimo szerokiego rozprzestrzenienia, populacje tego gatunku są mocno rozdrobnione, co może stanowić zagrożenie dla jego długoterminowego przetrwania, zwłaszcza w obliczu zmian w użytkowaniu gruntów i innych działań mających wpływ na jego siedliska.
populacja
Populacja tego gatunku jest uznawana za poważnie rozdrobnioną, głównie z powodu jego występowania w subalpejskich siedliskach na szczytach gór. Takie obszary działają jak wyspy kontynentalne, co utrudnia komunikację między subpopulacjami i ogranicza ich genetyczną wymianę. Dodatkowo, niszczenie odpowiednich siedlisk, które są już ograniczone do małych fragmentów, pogarsza sytuację gatunku, prowadząc do dalszej izolacji populacji.
Gatunek ten nie jest powszechnie spotykany, a jego obecność jest zazwyczaj rejestrowana w niewielkich liczbach. Brak jest danych dotyczących trendów populacji w Europie i UE, co utrudnia ocenę jego statusu. W związku z rozdrobnieniem populacji, ciągłe zagrożenie dla jego siedlisk oraz niewielką liczebnością, przyszłość tego gatunku wydaje się niepewna.
Siedlisko i ekologia
Gatunek ten preferuje otwarte, bogate w zioła tereny w lasach Abies/Picea (świerk/jodła), wznoszące się ku górze w wapiennych, nieulepszonych subalpejskich łąkach, które mogą występować znacznie powyżej granicy lasu. Tego typu obszary, szczególnie te w wyższych partiach gór, stanowią optymalne siedlisko dla tego gatunku. Dorosłe osobniki odwiedzają kwiaty różnych roślin, w tym białych baldaszkowatych, a także Anemone ranunculoides (zawilec żółty), Caltha (jaskier), Helianthemum (kocanki), Ranunculus (jaskier), Salix (wierzba), Senecio (seneccio) i Tanacetum (wrotycz). Zgodnie z raportem Bartscha (2009), gatunek został również odnotowany na Laserpitium latifolium (laserpitium szerokolistne). Okres lotu tego gatunku rozciąga się od końca maja do lipca, a na większych wysokościach może trwać aż do sierpnia. Niestety, roślina żywicielska oraz stadia niedojrzałe nie zostały jeszcze dokładnie opisane.
zagrożenia
Gatunek ten jest narażony na utratę siedlisk spowodowaną nadmiernym wypasem zwierząt gospodarskich w górskich obszarach, co prowadzi do degradacji naturalnych łąk. Dodatkowo, fragmentacja siedlisk wskutek przekształcania gruntów oraz intensyfikacji użytkowania ziemi, w tym procesów urbanizacyjnych, stanowi potencjalne zagrożenie dla lokalnych populacji tego gatunku.

4. Cheilosia loewi
Gatunek Cheilosia loewi został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia loewi znajduje się na liście gatunków zagrożonych.
Cheilosia loewi – Gatunek muchówki z rodziny bzygowatych (Syrphidae).
opis
Klasyfikacja taksonomiczna
- Rodzina: Syrphidae (Bzygowate)
- Rząd: Diptera (Muchówki)
- Gromada: Insecta (Owady)
- Typ: Arthropoda (Stawonogi)
wygląd.
Cheilosia loewi to niewielka, ciemno ubarwiona muchówka o krępej budowie ciała. Tułów matowy, czarny lub ciemnobrązowy, pokryty delikatnym owłosieniem. Odwłok ciemny, często z lekkim metalicznym połyskiem. Skrzydła przezroczyste, lekko przydymione, z wyraźnym użyłkowaniem charakterystycznym dla rodzaju Cheilosia. Nogi czarne lub ciemnobrązowe, smukłe.
Oczy samca holoptyczne (stykające się ze sobą), natomiast u samicy rozdzielone szerokim czołem (dychoptyczne). Czułki krótkie, trójczłonowe, z dobrze widoczną wicią.
aktywność
Dorosłe osobniki są aktywne od wiosny do późnego lata. Największa liczba obserwacji przypada na miesiące od maja do sierpnia.
pokarm
Dorosłe muchówki żywią się nektarem i pyłkiem kwiatowym. Larwy są fitofagiczne i rozwijają się wewnątrz roślin żywicielskich, zazwyczaj w łodygach lub korzeniach określonych gatunków roślin.
podobne gatunki
Cheilosia loewi może być mylona z innymi przedstawicielami rodzaju Cheilosia, zwłaszcza z blisko spokrewnionymi gatunkami o ciemnym ubarwieniu. Do dokładnej identyfikacji niezbędna jest analiza cech morfologicznych, takich jak kształt czułków, owłosienie tułowia i charakterystyczne użyłkowanie skrzydeł.
zasięg geograficzny
Gatunek ten występuje w południowej Polsce, Francji, Hiszpanii, Niemczech, Szwajcarii, Liechtensteinie, Austrii, Włoszech, Bośni i Hercegowinie, Bułgarii, Czarnogórze, Słowenii oraz Rumunii. Jego obecność w Chorwacji jest niepewna, a brak potwierdzonych danych o występowaniu w Serbii – doniesienia z niskich wysokości mogą wynikać z błędnej identyfikacji. W Europie szacowany obszar zajętości (AOO) wynosi około 188 km², a w UE 27 około 172 km². Zasięg występowania (EOO) w Europie szacuje się na około 1 515 637 km², a w UE na około 1 413 093 km².
populacja
Brak jest dokładnych informacji na temat liczebności populacji tego gatunku. Istnieją zarówno starsze zapisy (sprzed ponad 100 lat), jak i nowsze obserwacje (około 2011 roku oraz z lat 2017–2020). Gatunek ten, jako wysokogórski, prawdopodobnie nie ma możliwości łączności między subpopulacjami, co dodatkowo utrudnia ocenę jego stanu. Jest to gatunek bardzo tajemniczy – wszystkie dostępne dane opierają się na nielicznych okazach, znalezionych w subpopulacjach charakteryzujących się pozornie niską gęstością występowania.
siedlisko i ekologia
Gatunek ten preferuje naturalne, niezmienione górskie łąki w strefie lasów świerkowych (Picea) oraz wyżej położone subalpejskie łąki, sięgające nawet powyżej 2000 m n.p.m. Często występuje w pobliżu przesiąków wodnych lub strumieni. Dorosłe osobniki latają wśród traw na otwartych terenach, od górnej granicy lasów świerkowych aż po wyższe partie gór. Odwiedzają kwiaty roślin z rodzajów Euphorbia (wilczomlecz), Myosotis (niezapominajka), Potentilla verna (pięciornik wiosenny) oraz Ranunculus (jaskier). Okres lotu trwa od maja do lipca. Dotychczas nie opisano stadiów rozwojowych tego gatunku.
zagrożenia
Cheilosia loewi jest gatunkiem uznawanym za zagrożony ze względu na ograniczony obszar występowania (188 km² w Europie i 172 km² w UE27) oraz silnie rozdrobnioną populację. Jako gatunek wysokogórski, nie ma możliwości łączności między subpopulacjami, co dodatkowo zwiększa jego podatność na zagrożenia. W całej Europie obserwuje się ciągły spadek zasięgu i jakości siedlisk tego gatunku, spowodowany głównie rozwojem turystyki zimowej oraz nadmiernym wypasem na górskich łąkach. Dodatkowo, zmiany klimatyczne stanowią poważne zagrożenie, ponieważ gatunki wysokogórskie są szczególnie narażone na ich skutki.
Najpoważniejsze zagrożenia dla Cheilosia loewi to:
- Rozwój turystyki zimowej, prowadzący do niszczenia siedlisk wysokogórskich.
- Nadmierny wypas na górskich łąkach, który wpływa na degradację środowiska.
- Zmiany klimatyczne, które mogą prowadzić do utraty odpowiednich warunków siedliskowych.
Aby skutecznie chronić ten gatunek, niezbędne są dalsze badania nad jego ekologią oraz regularny monitoring populacji. Działania ochronne powinny koncentrować się na zachowaniu siedlisk wysokogórskich i ograniczeniu presji ze strony turystyki oraz nadmiernego wypasu.

5. Cheilosia montana
W Europie gatunek Cheilosia montana został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia montana znajduje się na liście gatunków zagrożonych. Cheilosia montana to przedstawiciel bzygowatych (Syrphidae), charakteryzujący się typowymi dla rodzaju Cheilosia cechami budowy ciała.
W Polsce prawdopodobnie jest wymarły.
opis
cechy ogólne
- Średniej wielkości muchówka, o krępej sylwetce, typowej dla gatunków z tej grupy.
- Ciało ciemne, pokryte delikatnymi włoskami, nadającymi lekko matowy wygląd.
- Odwłok szeroki, lekko spłaszczony, z metalicznym połyskiem, może mieć subtelne odcienie brązu lub miedzi.
głowa
- Czułki krótkie, trójczłonowe, z ciemnym trzecim członem (niekiedy lekko rozjaśnionym u podstawy).
- Twarz owłosiona, z wyraźnie zaznaczonymi zagłębieniami w pobliżu nasady czułków.
- Oczy duże, zajmujące znaczną część głowy, nie rozdzielone przez szerokie czoło u samców. U samic czoło jest szersze.
tułów
- Scutellum (tarczka) lekko wypukłe, ciemne, pokryte krótkimi, jasnymi włoskami.
- Skrzydła przezroczyste z delikatnym przydymieniem przy krawędziach, żyłkowanie typowe dla rodzaju Cheilosia.
nogi
- Stosunkowo długie i smukłe, ubarwienie w większości ciemne, miejscami lekko przyciemnione lub rozjaśnione na stawach.
- Uda mocno zbudowane, szczególnie w odnóżach tylnych.
różnice między płciami
- Samce mają bardziej zwarte ciało, węższe czoło i silniej owłosione odwłoki.
- Samice wyróżniają się szerszym czołem i nieco jaśniejszym owłosieniem.
Gatunek ten jest bardzo podobny do Cheilosia alpina, a ich odróżnienie, zwłaszcza u samic, pozostaje trudne bez szczegółowej analizy morfologicznej, najlepiej pod binokularem.
cechy odróżniające Cheilosia montana od innych gatunków Montanocheila:
kształt i proporcje ciała
- C. montana ma bardziej krępą sylwetkę i nieco krótsze odwłok niż inne gatunki z tej grupy.
- alpina jest smuklejsza, z bardziej wydłużonym odwłokiem.
ubarwienie ciała
- Ciemne, matowe ciało z delikatnym metalicznym połyskiem.
- Odwłok i scutellum pokryte gęstymi, jasnymi włoskami, co odróżnia go od niektórych gatunków o bardziej błyszczącym odwłoku.
czułki
- Trzeci człon czułków jest ciemny, podczas gdy u innych gatunków może być jaśniejszy.
owłosienie
- Gęstsze owłosienie twarzy niż u większości przedstawicieli grupy.
- Jasne włoski na scutellum i odwłoku, które są krótsze niż u niektórych pokrewnych gatunków.
zachowanie i siedlisko
- C. montana preferuje murawy subalpejskie i wysoko położone otwarte tereny, gdzie często odpoczywa na kamieniach.
- Samce unoszą się do 5 m nad ziemią, co jest charakterystycznym zachowaniem w pobliżu skał i wyeksponowanych struktur terenu.
Terminalia (narządy rozrodcze samców)
- Claussen (1998) opisał terminalia samców C. montana, które różnią się od innych gatunków Montanocheila.
- Rozróżnienie samic jest znacznie trudniejsze i wymaga dokładnej analizy morfologicznej.
zakres występowania
Ten europejski endemit występuje w górskich regionach Europy – od północnej Hiszpanii na zachodzie, przez Alpy w Europie Środkowej, aż po Karpaty i Rodopy w Rumunii oraz Bułgarii na wschodzie.
Powierzchnia zajętości (AOO – Area of Occupancy), czyli faktyczny obszar, na którym gatunek jest obecnie obserwowany, wynosi 112 km² w Europie, z czego 96 km² przypada na obszar Unii Europejskiej (UE-27). Zakres występowania (EOO – Extent of Occurrence), oznaczający całkowity obszar, w którym dany gatunek może potencjalnie występować, jest znacznie większy zarówno w Europie, jak i w UE.
populacja
Na podstawie wszystkich dostępnych danych dotychczas zebrano około 30 okazów. Trend populacji w Europie i na obszarze UE-27 pozostaje nieznany. Ze względu na silne rozdrobnienie odpowiednich siedlisk populacja jest uznawana za poważnie rozproszoną zarówno w Europie, jak i w UE
siedlisko i ekologia
Gatunek ten występuje na nieulepszonych subalpejskich terenach trawiastych, zarówno wapiennych, jak i niewapiennych. Dorosłe osobniki najczęściej odpoczywają na skałach i kamieniach, wygrzewając się na słońcu. Są aktywne od początku lipca do końca sierpnia. Dotychczas larwa nie została opisana.
zagrożenia

6. Cheilosia nivalis
Cheilosia nivalis została ostatnio oceniona pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia nivalis znajduje się na liście gatunków zagrożonych.
Cheilosia nivalis to gatunek muchówki z rodziny łaskowatych (Syrphidae), który należy do grupy zwanej „wzgórzowcami” (ang. hoverflies). Charakteryzuje się następującymi cechami:
opis
wygląd:
- Dorosły osobnik: Cheilosia nivalis ma ciemne, mocno zbudowane ciało. Ciało jest głównie czarne, z metalicznym połyskiem, co nadaje mu dość charakterystyczny wygląd. Głowa jest szeroka, a oczy duże, z wyraźnym podziałem na lewą i prawą część. Na ciele występują charakterystyczne, żółte i pomarańczowe plamy, które są widoczne na tułowiu i skrzydłach.
- Skrzydła: Skrzydła są przezroczyste, o delikatnym, lekko brunatnym zabarwieniu na krawędziach, z wyraźnymi żyłkami. Widać na nich wyraźne linie, które są charakterystyczne dla tego gatunku.
- Nogi i czułki: Nogi są ciemne, ale z wyraźnymi, żółtymi odcieniami na końcach. Czułki są stosunkowo krótkie w porównaniu do reszty ciała, co również wyróżnia ten gatunek.
rozmiar:
- Długość ciała: W pełni rozwinięty osobnik Cheilosia nivalis ma długość ciała około 6-8 mm, co czyni go stosunkowo małym, ale wyraźnie zauważalnym w swoim naturalnym środowisku.
rozwój:
Larwy tego gatunku są nieopisane, ale jak wiele muchówek z rodziny Syrphidae, prawdopodobnie rozwijają się w roślinnych resztkach lub na roślinach, które są ich pokarmem w stadium larwalnym. Dorośli preferują siedzenia na roślinach, zwłaszcza w miejscach nasłonecznionych, takich jak kwiaty ranunculusa (ranunculus) czy sisymbrium.
Ten gatunek jest typowy dla wyższych partii górskich, gdzie preferuje kamieniste, otwarte tereny.
zasięg geograficzny
Ten europejski endemit występuje w górzystych rejonach zachodniej i środkowej Europy, rozciągając się od Hiszpanii po zachodnią Rumunię. Dane z Polski są pomijane, ponieważ pochodzą z przestarzałych i niezweryfikowanych obserwacji. Na podstawie dostępnych danych w Europie, obszar zajętości (AOO) wynosi 116 km², z czego 88 km² znajduje się w Unii Europejskiej.
populacja
Na podstawie dostępnych raportów odnotowano jedynie kilka okazów w okresie od 1906 do 2019 roku. Ostatni przypadek miało miejsce w 2019 roku, kiedy to zebrano trzy okazy w Pirenejach we Francji. Trend populacji w Europie i UE jest nieznany, jednak przypuszcza się, że jest ona poważnie rozdrobniona, ponieważ gatunek występuje głównie na dużych wysokościach, co sprawia, że subpopulacje są izolowane. Z tego powodu populację uznaje się za poważnie rozdrobnioną zarówno w Europie, jak i w UE.
habitat i ekologia
Preferencje środowiskowe tego gatunku obejmują kamieniste, otwarte obszary wzdłuż rzek, potoków lub dróg, a także nieużywane łąki w wyższych partiach lasów, takich jak lasy jodłowe (Abies) i świerkowe (Picea), oraz wyższe strefy lasów z sosną limbiową (Pinus cembra) i sosną górską (Pinus mugo). Gatunek ten można spotkać również na słabo zarośniętych, wapiennych lub niewapiennych łąkach subalpejskich.
Dorosłe osobniki tego gatunku preferują ciepłe, słoneczne miejsca, gdzie odpoczywają na niskich lub dużych roślinach zielnych. Często odwiedzają kwiaty takich roślin jak jaskier (Ranunculus) i łaskotka (Sisymbrium). Okres lotu trwa od połowy maja do lipca, a na większych wysokościach może trwać do sierpnia.
Larwa tego gatunku nie została jeszcze dokładnie opisana.
sytuacja w Polsce
Cheilosia nivalis to gatunek występujący głównie w górskich regionach Europy. W Polsce jest uznawany za rzadki i trudny do zaobserwowania. Jego obecność jest związana z wysokogórskimi siedliskami, zwłaszcza w Tatrach, gdzie występuje w wyższych partiach górskich, w strefie subalpejskiej i alpejskiej. Gatunek ten preferuje otwarte, kamieniste tereny w pobliżu strumieni, łąk górskich i innych, mało zmienionych przez działalność ludzką środowisk.
W Polsce Cheilosia nivalis jest notowana sporadycznie, zaledwie w kilku lokalizacjach, co czyni ją gatunkiem rzadkim i narażonym na zagrożenia związane z degradacją siedlisk. Pomimo jej ograniczonego zasięgu w Polsce, brak jest dokładnych danych na temat jej liczebności i tendencji populacji. Należy podkreślić, że gatunek ten, jak wiele innych górskich organizmów, może być podatny na zmiany klimatyczne, które mogą wpłynąć na jego naturalne środowisko w wyższych partiach gór.
zagrożenia
Głównymi zagrożeniami dla tego gatunku są utrata siedlisk spowodowana zmianami w użytkowaniu gruntów, intensyfikacją zarządzania pastwiskami oraz presją wypasu na europejskich pastwiskach. Zmiany klimatyczne mogą również wpłynąć na ten gatunek, ponieważ choć występuje również na niższych wysokościach, jest głównie związany z górskimi siedliskami. Wzrost temperatury oraz zmiany w warunkach środowiskowych mogą zagrażać jego przetrwaniu, zwłaszcza w wyższych partiach gór, które stanowią główny obszar jego występowania.

7. Cheilosia pini.
Cheilosia pini została ostatnio oceniona pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia pini znajduje się na liście gatunków zagrożonych.
Cheilosia pini to gatunek muchówki z rodziny syrfidae (kózkowate), który charakteryzuje się dość typowym wyglądem dla przedstawicieli tej rodziny.
opis
wygląd:
- Długość ciała: Samce tego gatunku osiągają długość ciała około 8-9 mm, podczas gdy samice są nieco większe.
- Ubarwienie: Ciało jest ciemne, z odcieniami brązowymi lub czarnymi. Przedplecze (część tułowia) jest wyraźnie owłosione, a jego kolor może być brązowy do czarnego.
- Oczy: Oczy są ciemne, duże, zajmujące większość głowy.
- Czułki: Czułki są krótkie, ciemne, z wyraźnym, ale prostym kształtem, typowe dla przedstawicieli tej rodziny.
- Skrzydła: Skrzydła są przejrzyste, o delikatnym, szaro-brązowym odcieniu, z wyraźnymi żyłkami.
- Nogi: Nogi są ciemne, zwykle o jednolitym kolorze.
- Inne cechy: Na odwłoku widać wyraźne ciemniejsze linie lub plamy, zwłaszcza w okolicach końca ciała.
Habitus: Cheilosia pini ma dość charakterystyczny wygląd, z wyraźnymi cechami wyróżniającymi ją od innych przedstawicieli swojego rodzaju. Zwykle nie jest szczególnie jaskrawo ubarwiona, ale jej ciemne odcienie i wyraźne kontury pozwalają na łatwe rozpoznanie.
Ogólnie: Jest to niewielki, ciemny gatunek muchówki, którego wygląd, choć skromny, pasuje do klasycznego wyglądu przedstawicieli rodziny syrfidae.
zasięg geograficzny
Gatunek ten jest endemiczny dla Europy i występuje we Francji, Niemczech, Słowacji, Austrii, Bośni i Hercegowinie, Czarnogórze oraz Rumunii.
Historyczne zapisy wskazują również na jego obecność w Polsce i Czechach, jednak brak nowszych danych sprawia, że jego dalsze występowanie w tych krajach pozostaje niepewne. W Europie szacunkowy zasięg występowania wynosi 381 286 km², natomiast powierzchnia faktycznie zajmowana przez populacje tego gatunku to 36 km². W krajach Unii Europejskiej zasięg ten wynosi 210 450 km², a powierzchnia zajmowana – 20 km².
populacja
Brak jest danych na temat wielkości populacji oraz trendów tego gatunku. Dotychczas zebrano około 30 okazów, ostatni z 2012 roku. Gatunek ten ma wczesny okres lotu, co sugeruje, że brak pełnych danych może wynikać z ograniczonego sezonu badań. Populacja tego gatunku uznawana jest za silnie rozdrobnioną, ponieważ występuje głównie w regionach górskich, związanych z lasami i górskimi łąkami, które znajdują się pod dużą presją. W efekcie zmniejsza się łączność między subpopulacjami, co dodatkowo utrudnia monitorowanie i zachowanie gatunku.
siedlisko i ekologia
Gatunek ten występuje w wilgotnych lasach liściastych i mieszanych, szczególnie w lasach bukowo-świerkowych oraz na wilgotnych górskich łąkach, na wysokości około 1100 m n.p.m. Samce tego gatunku odwiedzają kwiaty wierzby (Salix) oraz knieci (Caltha), które stanowią ważne źródło pożywienia. Okres lotu tego gatunku trwa od wczesnej wiosny, począwszy od kwietnia, aż do lipca. Do tej pory nie są znane stadia rozwojowe larw ani rośliny żywicielskie tego gatunku, co pozostaje obszarem do dalszych badań.
zagrożenia
Główne zagrożenia dla tego gatunku obejmują zniszczenie siedlisk spowodowane wycinką lasów w ramach działalności leśnej nastawionej na cele komercyjne, intensyfikacją rolnictwa oraz rozwojem infrastruktury. Te czynniki prowadzą do degradacji naturalnych środowisk, w których gatunek ten występuje, zmniejszając dostępność odpowiednich siedlisk oraz fragmentując populacje.
8. Corticeus versipellis
Corticeus versipellis został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2016 r. Corticeus versipellis znajduje się na liście gatunków zagrożonych.
opis
gabus clypealis to gatunek wodnego chrząszcza należącego do rodziny dytiscyd (Dytiscidae), zwanych również nurkującymi chrząszczami.
wygląd:
- Ciało: Owalne, spłaszczone, doskonale przystosowane do życia w wodzie. Ubarwienie jest zazwyczaj ciemne, od czarnego do głębokiego brązu, często z metalicznym połyskiem, co ułatwia kamuflaż w środowisku wodnym.
- Głowa: Stosunkowo szeroka, z wyraźnie zaznaczonym clypeus – charakterystyczną osłoną czołową, od której pochodzi nazwa gatunku.
- Nogi: Tylne nogi są silnie rozwinięte, spłaszczone i pokryte drobnymi włoskami, co umożliwia efektywne pływanie.
zasięg geograficzny
Corticeus versipellis to gatunek endemiczny dla Europy Środkowej, znany zaledwie z 1–2 lokalizacji w każdym z dziewięciu krajów, przy czym w niektórych uważa się go za wymarłego lub występującego wątpliwie. Najnowsze zapisy, pochodzące od 2000 roku, dostępne są wyłącznie z Republiki Czeskiej (Novák, 2014). W Europie zasięg występowania (EOO) wynosi około 214 255 km², a obszar występowania (AOO) – 56 km². W krajach UE-28 EOO szacuje się na około 187 158 km², natomiast AOO na 52 km².
populacja
W Polsce sytuacja Corticeus versipellis jest niepewna i wymaga potwierdzenia. Gatunek ten jest niezwykle rzadki, a większość doniesień o jego występowaniu w kraju pochodzi ze starych lub niepotwierdzonych źródeł. Brakuje aktualnych danych na temat jego obecności, co utrudnia ocenę stanu populacji. Jeśli gatunek rzeczywiście występuje w Polsce, prawdopodobnie jest ograniczony do nielicznych, izolowanych stanowisk, podobnie jak w innych krajach Europy.
Obecny trend populacji Corticeus versipellis maleje. W Austrii, Włoszech, Rumunii i Szwajcarii jego obecność również wymaga weryfikacji. W Szwajcarii występowanie tego gatunku jest teoretycznie możliwe, jednak brakuje potwierdzonych obserwacji. Wątpliwości budzi również obecność Corticeus versipellis w typowej lokalizacji w Toskanii, gdyż od czasu pierwotnego opisu nie odnotowano go ponownie we Włoszech.
Gatunek ten znany jest z około 14 bardzo odizolowanych stanowisk, wliczając wątpliwe zapisy. Wszystkie subpopulacje są małe, silnie odizolowane i narażone na wyginięcie, przy czym szanse na naturalną ponowną kolonizację są minimalne. W związku z tym populacja Corticeus versipellis jest uważana za poważnie rozdrobnioną, co dodatkowo zwiększa jej podatność na zagrożenia.
Ze względu na brak aktualnych obserwacji i potwierdzonych informacji, Corticeus versipellis może być w Polsce gatunkiem zagrożonym lub nawet wymarłym. Konieczne są dalsze badania terenowe oraz monitoring, aby zweryfikować jego obecność i określić aktualny stan populacji. W przypadku potwierdzenia występowania, gatunek ten wymagałby pilnych działań ochronnych, aby zapobiec jego całkowitemu zanikowi.
Siedlisko i ekologia
Siedlisko i ekologia tego gatunku pozostają w dużej mierze nieznane. Gatunek ten nie wydaje się być silnie powiązany z konkretnymi kornikami, choć można go znaleźć pod korą martwych pni wiązów (Ulmus spp.). Zbierano go poprzez przesiewanie materiału znajdującego się pod korą, w drewnie rozkładającym się pod wpływem pleśni oraz w zgniłym materiale. Obserwacje wskazują, że występuje on pod korą martwych lub prawie martwych wiązów, gdzie często obecne są korniki z rodzaju Scolytus. W Budapeszcie jeden okaz został odnaleziony w lesie bukowym już w latach 80.
zagrożenie
Corticeus versipellis to gatunek endemiczny dla Europy Środkowej, znany zaledwie z 1–2 lokalizacji w każdym z dziewięciu krajów, a w kilku z nich uznawany za wymarły lub występujący wątpliwie. Najnowsze zapisy dotyczą wyłącznie Republiki Czeskiej. Całkowity obszar występowania (AOO) wynosi około 56 km² w Europie (52 km² w UE), a populacja jest silnie rozdrobniona – zarówno zasięg występowania (EOO), jak i jakość siedlisk oraz liczba subpopulacji systematycznie maleją.
Gatunek jest bardzo słabo poznany, a zagrożenia nie są jeszcze dobrze udokumentowane. Jednym z potencjalnych problemów jest holenderska choroba wiązów, która powoduje gwałtowny spadek liczby drzew wiązowych (Ulmus spp.). Jeśli gatunek rzeczywiście jest związany z chrząszczami z rodzaju Scolytus występującymi na wiązach, to zanikanie tych drzew może stanowić istotne zagrożenie. Obecnie dostępnych jest bardzo niewiele niedawnych lokalizacji, a rzeczywisty obszar występowania może być mniejszy niż 20 km².
Konieczne są dalsze badania mające na celu dokładne określenie rozmieszczenia geograficznego, charakterystyki siedlisk, historii życia oraz wpływu zagrożeń na populację tego gatunku, co pozwoli lepiej zrozumieć jego stan i zidentyfikować inne potencjalne ryzyka.
siedlisko i ekologia:
Agabus clypealis występuje w czystych, dobrze natlenionych zbiornikach wodnych, takich jak jeziora, stawy oraz wolno płynące rzeki. Preferuje środowiska z bogatą roślinnością wodną, która zapewnia schronienie oraz sprzyja rozmnażaniu. Gatunek ten pełni rolę drapieżnika, polując na drobne bezkręgowce wodne zarówno w stadium dorosłym, jak i larwalnym. Larwy również są aktywne i drapieżne, przyczyniając się do regulacji populacji innych organizmów w ekosystemie wodnym.
znaczenie:
Agabus clypealis jest ważnym bioindykatorem, czyli wskaźnikiem jakości środowiska wodnego. Jego obecność świadczy o czystości i dobrej kondycji zbiorników wodnych.

9. Idänvaskinen (Orthonevra plumbago)
Gatunek Orthonevra plumbago został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Orthonevra plumbago znajduje się na liście gatunków zagrożonych.
Orthonevra plumbago to europejski endemit, charakteryzujący się bardzo rzadkim, ale dość szerokim rozmieszczeniem. Gatunek ten jest blisko spokrewniony z Orthonevra incisa i Orthonevra brevicornis. Speight i Castella (2011) wskazują cechy odróżniające O. brevicornis od O. plumbago. Niektórzy autorzy sugerują, że O. incisa może być synonimem O. plumbago, jednak synonimia ta nigdy nie została formalnie potwierdzona.
rthonevra plumbago to gatunek muchówki z rodziny bzygowatych (Syrphidae), charakteryzujący się dość charakterystycznym wyglądem, typowym dla przedstawicieli rodzaju Orthonevra.
opis
Cechy morfologiczne:
- Wielkość: Jest to mały owad, osiągający długość ciała około 4–6 mm.
- Ubarwienie: Ciało Orthonevra plumbago ma metaliczny, ciemnoniebieski lub zielonkawy połysk, co nadaje mu charakterystyczny, lśniący wygląd. Ubarwienie może nieco różnić się w zależności od kąta padania światła.
- Głowa: Głowa jest stosunkowo szeroka, z dużymi oczami złożonymi, które u samców mogą stykać się ze sobą na czubku głowy. Czułki są krótkie, z wyraźnym, owłosionym aristą (włoskiem na trzecim członie czułka).
- Tułów: Tułów jest krępy, z metalicznym połyskiem, podobnie jak reszta ciała. Skrzydła są przezroczyste, z delikatnym użyłkowaniem.
- Odwłok: Odwłok jest krótki i szeroki, z wyraźnym metalicznym połyskiem. U samic może być nieco bardziej zaokrąglony niż u samców.
- Nogi: Nogi są stosunkowo krótkie i ciemne, z lekkim połyskiem.
Charakterystyczne cechy:
- Orthonevra plumbago można odróżnić od podobnych gatunków z rodzaju Orthonevra (np. Orthonevra incisa czy Orthonevra brevicornis) dzięki szczegółom budowy czułków, kształtu głowy oraz użyłkowania skrzydeł. Jednak dokładna identyfikacja często wymaga analizy pod mikroskopem.
Podobieństwa do innych gatunków:
- Gatunek ten jest często mylony z innymi przedstawicielami rodzaju Orthonevra, zwłaszcza z Orthonevra incisa. Różnice między nimi są subtelne i dotyczą m.in. kształtu czułków oraz szczegółów budowy narządów rozrodczych.
Orthonevra plumbago to gatunek o subtelnym, ale efektownym wyglądzie, typowym dla małych, metalicznie ubarwionych bzygowatych. Jego identyfikacja w terenie może być trudna bez specjalistycznej wiedzy i sprzętu.
zasięg geograficzny
Orthonevra plumbago to gatunek endemiczny, odnotowany w południowo-wschodniej Finlandii, na Łotwie, Litwie, w Polsce, Francji (Alpy), Czechach, Szwajcarii, Słowacji, Włoszech, Węgrzech, Rumunii, Bułgarii, Mołdawii, Ukrainie oraz w europejskiej części Rosji. Istnieją jednak przesłanki, że gatunek ten prawdopodobnie wyginął we Włoszech, Finlandii i na Ukrainie. Warto zaznaczyć, że niektóre wcześniejsze doniesienia z Niemiec, przypisywane Orthonevra plumbago, w rzeczywistości dotyczą Orthonevra incisa.
Dokładne dane dotyczące lokalizacji występowania tego gatunku są często niepełne lub trudno dostępne, co utrudnia precyzyjne obliczenie zasięgu występowania (EOO) oraz obszaru zajmowanego (AOO). Mimo to, dostępne informacje wskazują, że Orthonevra plumbago ma ograniczony i rozproszony zasięg, co podkreśla potrzebę dalszych badań i monitorowania jego populacji.
Siedlisko i ekologia
Jedynymi dostępnymi informacjami na temat siedliska Orthonevra plumbago są te zawarte w Speight (2020). Zgodnie z tym źródłem, gatunek ten preferuje źródła i wypływy wód w sezonowo zalewanych, oligotroficznych lub mezotroficznych, bogatych w zioła bagnach porośniętych trzciną (Phragmites). Ponadto występuje na dobrze przepuszczalnych, piaszczystych glebach oraz na małych, otwartych obszarach z wypływami wód w lasach z udziałem olszy szarej (Alnus incana).
Larwy tego gatunku nie są znane, ale prawdopodobnie rozwijają się w słodkiej wodzie, w pobliżu siedlisk zajmowanych przez dorosłe osobniki, podobnie jak u innych gatunków z rodzaju Orthonevra. Mimo że dokładne preferencje siedliskowe i wymagania środowiskowe Orthonevra plumbago nie są w pełni poznane, gatunek ten ma specyficzne potrzeby i wymaga połączenia siedlisk lądowych oraz wodnych.
W całym zasięgu występowania obserwuje się ciągły spadek jakości i dostępności odpowiednich siedlisk dla innych gatunków z rodzaju Orthonevra, co prawdopodobnie dotyczy również Orthonevra plumbago. Ten trend wskazuje na pilną potrzebę ochrony i odtwarzania jego naturalnych siedlisk, aby zapobiec dalszemu spadkowi liczebności populacji.
populacja
Wielkość populacji Orthonevra plumbago oraz jej trend są nieznane. Subpopulacje tego gatunku są bardzo małe i silnie rozproszone, co wskazuje na poważne rozdrobnienie. Ich żywotność jest wątpliwa, a wiele z nich może być na tyle niewielkich, że grozi im natychmiastowe wyginięnie. Szacuje się, że wszystkie istniejące lokalizacje (przypuszczalnie około 10) są na tyle małe i izolowane, że są wyjątkowo podatne na zagrożenia, takie jak zmiany środowiskowe czy utrata siedlisk.
Brak danych na temat trendów populacyjnych oraz ekstremalnie małe i rozproszone subpopulacje podkreślają pilną potrzebę badań i działań ochronnych, aby zapobiec całkowitemu wymarciu tego gatunku.
zagrożenia
Choć dokładne zagrożenia dla Orthonevra plumbago nie są w pełni poznane, prawdopodobnie obejmują one degradację siedlisk spowodowaną drenażem, depozycją azotu oraz zmianami klimatu. Podobne zagrożenia dotykają również inne gatunki z rodzaju Orthonevra. W Finlandii gatunek ten może być już wymarły, a we Francji jest wyraźnie zagrożony. W skali Europy Orthonevra plumbago uznawany jest za gatunek zagrożony, głównie ze względu na bardzo mały obszar zajmowany (AOO – Area of Occupancy), który prawdopodobnie nie przekracza 40 km².
rozdrobnienie i spadek jakości siedlisk
Gatunek ten jest uważany za silnie rozdrobniony, a jego subpopulacje są małe i izolowane. Na całym obszarze występowania obserwuje się ciągły spadek jakości siedlisk, co stanowi dodatkowe ryzyko dla jego przetrwania. Biologia Orthonevra plumbago pozostaje słabo poznana, co utrudnia precyzyjne określenie głównych zagrożeń. Jednak podobnie jak w przypadku innych gatunków z rodzaju Orthonevra, prawdopodobnie cierpi on z powodu utraty siedlisk, zmian hydrologicznych oraz wpływu zmian klimatycznych.
Potrzeba ochrony
Ze względu na rzadkość, rozdrobnienie populacji oraz brak szczegółowych danych na temat biologii i ekologii tego gatunku, niezbędne są dalsze badania oraz działania ochronne. Kluczowe jest zachowanie i odtwarzanie naturalnych siedlisk, w których występuje Orthonevra plumbago, aby zapewnić przetrwanie tego unikalnego europejskiego endemitu.

10. Korosz dwubarwny. Korówka dwubarwna. (Corticeus bicoloroides)
Corticeus bicoloroides został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2016 r. Corticeus bicoloroides znajduje się na liście gatunków zagrożonych.
zagrożenie
Siedliska, w których występuje Brachyopa maculipennis – zalewowe równiny nadrzeczne, lasy galeriowe oraz mezo- i eutroficzne lasy dębowe i grabowe – są oceniane jako bliskie zagrożenia lub zagrożone. W Europie obserwuje się gwałtownie pogarszającą się jakość i redukcję lasów aluwialnych, co bezpośrednio wpływa na spadek powierzchni zajmowanych (AOO) oraz degradację siedlisk, od których gatunek jest zależny.
Wśród głównych zagrożeń wymienia się działalność turystyczną, wycinkę drzew, rolnictwo oraz stosowanie nawozów i pestycydów. W kilku krajach Unii Europejskiej gatunek nie był odnotowywany przez wiele dziesięcioleci, co sugeruje, że populacje są krytycznie zagrożone lub nawet wymarłe w tych rejonach.
Na poziomie całej Europy AOO szacuje się na 192–384 km², co klasyfikuje gatunek jako zagrożony. W krajach UE-27 sytuacja jest jeszcze bardziej alarmująca – AOO wynosi od 124 do maksymalnie 248 km², a przy uwzględnieniu prawdopodobnego wyginięcia siedlisk w niektórych państwach, rzeczywisty obszar występowania może wynosić maksymalnie 124 km². Te dane potwierdzają, że Brachyopa maculipennis jest poważnie zagrożonym gatunkiem w całej Europie.

14. Pihkakeilanen (Cheilosia morio)
Gatunek Cheilosia morio został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia morio znajduje się na liście gatunków zagrożonych.
opis.
Cheilosia morio, jest to rzadko spotykany gatunek muchówki z rodziny bzygowatych (Syrphidae), należący do rodzaju Cheilosia. Oto szczegółowy opis jego cech morfologicznych:
Cechy morfologiczne
- Czoło samicy jest szerokie, co odróżnia ją od innych wyrówek.
- Twarz owłosiona, co stanowi charakterystyczną cechę gatunku.
- Czułki z trzecim członem w kolorze pomarańczowym.
- Scutellum (tarczka) oraz odwłok pokryte są krótkimi, żółtymi włoskami.
- Nogi ciemne, ale z miejscowymi jaśniejszymi obszarami.
- Gatunek bardzo podobny do Cheilosia luteicornis, z którym tworzy parę bliźniaczych gatunków – ich odróżnienie jest możliwe jedynie przy użyciu binokularu.
zasięg geograficzny
Zasięg występowania tego europejskiego endemitu pozostaje niepewny, głównie z powodu wcześniejszego mylenia go z Cheilosia luteicornis. Potwierdzone występowanie Cheilosia morio odnotowano w Niemczech, Grecji, Włoszech, Czarnogórze, Polsce, Szwecji, Francji, Czechach i na Słowacji. Istnieją także doniesienia o jego obecności w Norwegii, jednak wymagają one dalszej weryfikacji.
Niepewny pozostaje status gatunku w Austrii, gdzie pojedyncza obserwacja z 1995 roku nie została potwierdzona przez odnalezienie odpowiedniego okazu. Powierzchnia rzeczywistego występowania (AOO) w Europie wynosi 116 km², natomiast ogólny zasięg geograficzny (EOO) obejmuje 1 808 234 km². W krajach UE te wartości wynoszą odpowiednio 108 km² dla AOO i 1 749 885 km² dla EOO.
Obliczenia uwzględniają wyłącznie potwierdzone stanowiska, co oznacza, że przedstawione dane opierają się na ostrożnym podejściu, a rzeczywisty zasięg tego gatunku może być większy.
populacja
Brakuje dokładnych danych dotyczących trendów populacyjnych Cheilosia morio, a gatunek ten pozostaje rzadko spotykany, z niewielką liczbą udokumentowanych obserwacji. Największe znane subpopulacje występują w Szwecji, jednak ogólny trend liczebności w Europie i krajach UE pozostaje nieznany.
Populacja gatunku jest poważnie rozdrobniona – ponad połowa subpopulacji składa się z niewielkich, izolowanych grup, co może zwiększać ryzyko ich zanikania.
siedlisko i ekologia
Cheilosia morio występuje w podobnych środowiskach co Cheilosia luteicornis, jednak preferuje bardziej otwarte siedliska i wydaje się mieć bardziej ograniczony zasięg. Gatunek ten był obserwowany na wilgotnych łąkach, suchych terenach trawiastych oraz torfowiskach położonych w dużych kompleksach leśnych, zwłaszcza w lasach sosnowych.
Dorosłe osobniki odnotowano na kwiatach Anemone hepatica i Tussilago farfara, co sugeruje ich znaczenie jako źródła pożywienia. Okres lotu przypada na kwiecień i maj.
Brakuje szczegółowych informacji na temat rozwoju larwalnego C. morio, ale przypuszcza się, że – podobnie jak u pokrewnych gatunków – larwy są roślinożerne. Istnieją spekulacje, że rozwijają się w ranach kory wypełnionych żywicą, choć wymaga to dalszych badań. Dotychczasowe dane na temat ekologii tego gatunku są często mylnie przypisywane C. luteicornis z powodu wcześniejszych problemów taksonomicznych.
Ekologia i zachowanie
- Okres lotu przypada na kwiecień i maj.
- Dorosłe osobniki żerują na kwiatach, m.in. Anemone hepatica i Tussilago farfara.
- Rozwój larwalny nie został jeszcze dokładnie poznany, ale przypuszcza się, że – podobnie jak u pokrewnych gatunków – larwy są roślinożerne i mogą rozwijać się w ranach kory wypełnionych żywicą.
zagrożenia
Głównym zagrożeniem dla Cheilosia morio jest wycinka drzew i niewłaściwa gospodarka leśna, które prowadzą do utraty różnorodności strukturalnej lasów. Zmniejszenie liczby otwartych, wilgotnych terenów oraz degradacja torfowisk i łąk znacząco ograniczają dostępność odpowiednich siedlisk dla tego gatunku.
Nieodpowiednie zarządzanie obszarami leśnymi może prowadzić do zaniku naturalnych mikrośrodowisk, w których rozwijają się larwy i żerują dorosłe osobniki, co w dłuższej perspektywie może przyczynić się do dalszego spadku liczebności populacji.
Gatunek ten jest rzadko spotykany i jego populacja jest poważnie rozdrobniona. Główne zagrożenia to utrata siedlisk, niewłaściwa gospodarka leśna oraz wycinka drzew, które prowadzą do zmniejszenia różnorodności strukturalnej lasów. Brak jest obecnie dedykowanych działań ochronnych, ale kluczowe siedliska powinny być objęte ochroną w ramach zrównoważonego zarządzania lasami.
działania ochronne
Obecnie brak jest konkretnych działań ochronnych skierowanych na Cheilosia morio. Aby zabezpieczyć przyszłość tego gatunku, konieczna jest ochrona kluczowych siedlisk, takich jak wilgotne łąki, torfowiska i otwarte tereny w dużych kompleksach leśnych. Włączenie tych obszarów do planów zrównoważonego zarządzania lasami mogłoby znacząco przyczynić się do zachowania populacji.
Ponadto, ze względu na niepewny status taksonomiczny i ograniczoną wiedzę o biologii gatunku, niezbędne są dalsze badania nad jego rozmieszczeniem, ekologią i cyklem życiowym. Regularny monitoring populacji i ich siedlisk pozwoliłby lepiej ocenić zagrożenia i skuteczniej planować środki ochronne.

15. Pilnicznik fiołkowy. Violet Click Beetle (Limoniscus violaceus).
Sprężykowy chrząszcz fioletowy Limoniscus violaceus został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2009 r. Limoniscus violaceus znajduje się na liście gatunków zagrożonych.
Limoniscus violaceus to nadzwyczaj rzadki i ginący gatunek stenotopowy (tj. organizm o bardzo wąskich wymaganiach siedliskowych, przystosowany do życia w specyficznych warunkach środowiskowych) , uznawany za relikt pierwotnych środowisk leśnych i lasostepowych. Jego przetrwanie jest ściśle związane z obecnością starych, dziuplastych drzew, co czyni go szczególnie wrażliwym na zmiany w ekosystemie.
Jako gatunek stenotopowy wymaga specyficznych warunków do rozwoju – zwłaszcza dobrze rozwiniętej warstwy próchnicy drzewnej powstającej w wyniku naturalnego rozkładu drewna. Wymieranie jego siedlisk, zwłaszcza w wyniku intensyfikacji gospodarki leśnej i utraty starodrzewów, stanowi jedno z największych zagrożeń dla tego gatunku.
opis
Violet Click Beetle (Limoniscus violaceus) to rzadki chrząszcz z rodziny sprężykowatych (Elateridae), wyróżniający się charakterystycznym wyglądem:
🔹 Kolor – Metalicznie fioletowy lub purpurowo-czarny połysk na pokrywach skrzydłowych, co nadaje mu unikalny i rozpoznawalny wygląd.
🔹 Rozmiar – Długość ciała wynosi od 8 do 12 mm.
🔹 Kształt – Smukłe, lekko wydłużone ciało, typowe dla chrząszczy sprężykowatych.
🔹 Czułki – Dość długie i lekko piłkowane, charakterystyczne dla przedstawicieli rodziny Elateridae.
🔹 Nogi – Stosunkowo krótkie, przystosowane do wspinaczki po korze i martwym drewnie.
Jest to owad rzadko spotykany, a jego metaliczny połysk sprawia, że wygląda wyjątkowo, szczególnie w świetle słonecznym.
Zasięg geograficzny
Pilnicznik fiołkowy to gatunek występujący nieciągle w Europie Środkowej, z pominięciem jej najbardziej wysuniętych na południe i północ obszarów. Jego populacje są rozproszone, a zasięg ograniczony. W Danii gatunek ten uznaje się za wymarły, ponieważ od około 100 lat nie odnotowano tam żadnych potwierdzonych obserwacji.
Gatunek występuje w sposób rozproszony na obszarze całej Europy, z wyjątkiem regionów skrajnie południowych i północnych (Laibner, 2000). W Danii gatunek wyginął i nie został tam odnotowany od około 100 lat (National Environmental Research Institute, 2007).
Populacja
Pilnicznik fiołkowy jest niezwykle rzadkim gatunkiem o rozproszonym zasięgu w całej Europie. W Wielkiej Brytanii występuje jedynie w izolowanych lokalizacjach – znany jest z dwóch obszarów w Anglii, z których jeden obejmuje dwa oddzielne stanowiska, jednak brak jest szczegółowych danych dotyczących wielkości populacji.
Na Węgrzech, zwłaszcza w terenach górzystych, odnotowano bardzo sporadyczne wystąpienia, a populacje są niewielkie. W Republice Czeskiej zanotowano kilka rozproszonych stanowisk, natomiast na Słowacji gatunek występuje na południu i we wschodnich rejonach, gdzie również zidentyfikowano kilka lokalizacji. W Niemczech potwierdzono istnienie do dziesięciu lokalizacji, z czego połowa została kilkakrotnie potwierdzona. We Francji gatunek występuje głównie w nizinnych, dużych i starożytnych lasach bukowych, gdzie odnotowano 15 znanych stanowisk.
W północnej Hiszpanii znany jest z czterech lokalizacji, z czego jedna jest bardzo stara. W Polsce natomiast odnotowano dwa stanowiska – jedno z 1870 roku i drugie z 1920 roku. W Danii gatunek prawdopodobnie wyginął, gdyż nie odnotowano go od około 100 lat (Państwowy Instytut Badawczy Środowiska, 2007).
Syrphidae – Bzygowate: Melanogaster curvistylus
opis
wygląd:
- Głowa: Czarna.
- Scutum (środkowa część tułowia): Czarne, błyszczące, pokryte żółtymi włoskami.
- Odwłok: Czarny; u samca wyraźnie smuklejszy niż u krępej samicy.
- Nogi: Czarne.
- Skrzydła: Przezroczyste.
wymiary: Długość ciała: 6–8 mm.
aktywność:
Okres aktywności dorosłych osobników trwa od kwietnia do sierpnia.
pokarm:
- Dorosłe osobniki: Nektar, pyłek, spadź.
- Larwy: Saprofagiczne, rozwijają się w rozkładającej się materii organicznej.
gatunki podobne:
- Krajowe gatunki z rodzaju Melanogaster: M. nuda, M. aerosa, M. parumplicata.
- Inne podobne gatunki: Melanogaster hirtella (prawdopodobnie nie występuje w Polsce).
uwagi:
Rozróżnienie gatunków z rodzaju Melanogaster wymaga szczegółowej analizy spodu ciała, najlepiej pod binokularem. Podobne są również inne czarne bzygowate, np. niektóre gatunki z rodzaju Cheilosia, które różnią się użyłkowaniem skrzydeł oraz profilem twarzy.
zasięg geograficzny
Melanogaster curvistylus to gatunek endemiczny dla Europy. Został odnotowany w Austrii, Bułgarii, Niemczech, na Węgrzech, w Polsce, Serbii oraz w rejonie Kursku (część europejska Rosji). Istnieją jednak przesłanki, że gatunek ten prawdopodobnie wyginął w Serbii.
Rozdrobnienie populacji
Populacja Melanogaster curvistylus jest silnie rozdrobniona, a jej subpopulacje są małe i izolowane. Mimo że zasięg występowania (EOO) zarówno w Europie, jak i w krajach UE jest stosunkowo duży, obszar zajmowany (AOO) jest bardzo ograniczony. W Europie szacuje się go na 28 km², a w krajach UE27 na 24 km².
Status i zagrożenia
Silne rozdrobnienie populacji oraz niewielki obszar zajmowany (AOO) sprawiają, że gatunek ten jest wyjątkowo narażony na zagrożenia, takie jak utrata siedlisk, zmiany klimatyczne oraz zanieczyszczenia środowiska. Konieczne są dalsze badania i działania ochronne, aby zapobiec całkowitemu wymarciu tego unikalnego europejskiego endemitu.
sytuacja w Polsce
Melanogaster curvistylus został po raz pierwszy odnotowany w Polsce w 1998 roku. Od tego czasu gatunek ten pozostaje niezwykle rzadki, a obecnie znanych jest zaledwie kilka stanowisk jego występowania. Jednym z kluczowych miejsc, gdzie go zaobserwowano, jest okolica Koniecpola nad Pilicą w województwie śląskim.
populacja
Wszystkie dotychczasowe obserwacje Melanogaster curvistylus dotyczą pojedynczych okazów, co sugeruje, że istniejące subpopulacje są prawdopodobnie bardzo małe. Trend liczebności populacji tego gatunku pozostaje nieznany, co wynika z braku systematycznych badań i monitorowania.
Gatunek ten jest uważany za silnie rozdrobniony. Dotychczas odnotowano jedynie siedem okazów, a każdy z nich pochodził z odległych od siebie lokalizacji. Tak duże rozproszenie sprawia, że interakcje między subpopulacjami są mało prawdopodobne, co dodatkowo zwiększa ryzyko ich izolacji i wymierania.
habitat i ekologia
Melanogaster curvistylus występuje w pobliżu stojących lub wolno płynących zbiorników wodnych, takich jak wilgotne lasy zalewowe rzek lub otwarte tereny trawiaste. Dorosłe osobniki są często obserwowane na roślinności zielnej, gdzie żerują lub odpoczywają.
Larwy tego gatunku rozwijają się w małych zbiornikach słodkiej wody, bogatych w rozkładającą się materię roślinną. Takie środowisko zapewnia im odpowiednie warunki do rozwoju, ale jednocześnie czyni je wrażliwymi na zmiany w jakości wody i dostępności siedlisk.
zagrożenie
Melanogaster curvistylus to europejski endemit, który jest gatunkiem zagrożonym ze względu na bardzo mały obszar występowania (AOO – Area of Occupancy), szacowany na zaledwie 28 km² (w tym 24 km² w krajach UE). Jego populacja jest silnie rozdrobniona, a gatunek został odnotowany tylko w siedmiu lokalizacjach, z czego pięć znajduje się w UE27. W każdej z tych lokalizacji obserwowano jedynie pojedyncze lub nieliczne okazy. Istnieją przesłanki, że gatunek ten prawdopodobnie wyginął w Serbii.
Zagrożenia dla siedlisk
Siedliska Melanogaster curvistylus są zagrożone i zanikają z powodu:
- zanieczyszczeń rolniczych, które wpływają na jakość wody i gleby,
- zmian klimatu, które mogą prowadzić do wysychania siedlisk,
- zmian w gospodarce wodnej, takich jak pobór wód gruntowych i powierzchniowych, które zaburzają naturalne warunki hydrologiczne.
Mimo że literatura naukowa nie wymienia konkretnych zagrożeń dla tego gatunku, jego sytuacja jest prawdopodobnie krytyczna. Bardzo małe i szeroko rozproszone subpopulacje, występujące w siedliskach podatnych na degradację, sprawiają, że Melanogaster curvistylus jest wyjątkowo narażony na wyginięcie.
Potrzeba ochrony
Ze względu na poważne rozdrobnienie populacji, niewielką liczbę lokalizacji oraz wrażliwość siedlisk na zmiany środowiskowe, niezbędne są pilne działania ochronne. Należą do nich:
- ochrona i odtwarzanie siedlisk wodno-lądowych,
- monitorowanie jakości wody i gleby,
- ograniczenie negatywnego wpływu rolnictwa oraz zmian klimatycznych.
Melanogaster curvistylus to gatunek, którego przetrwanie zależy od szybkich i skutecznych działań na rzecz zachowania jego naturalnych siedlisk.

17. Shielded Agabus Beetle (Agabus clypealis)
Agabus tarczowy Agabus clypealis został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 1996 r. Agabus clypealis znajduje się na liście gatunków zagrożonych.
Agabus clypealis to gatunek wodnego chrząszcza z rodziny dytiscyd (Dytiscidae), czyli nurkujących chrząszczy.
wygląd:
- Ciało: Owalne, spłaszczone, przystosowane do życia w środowisku wodnym. Ubarwienie jest zazwyczaj ciemne, od czerni do głębokiego brązu, z metalicznym połyskiem, co może ułatwiać kamuflaż w wodzie.
- Głowa: Stosunkowo szeroka, z wyraźnie zaznaczonym clypeus – charakterystyczną osłoną czołową, od której pochodzi nazwa gatunku.
- Nogi: Silnie rozwinięte tylnie nogi z błoniastego rodzaju, wyposażone w drobne włoski, ułatwiające efektywne pływanie.
siedlisko i ekologia:
Agabus clypealis występuje w czystych, dobrze natlenionych wodach słodkich, takich jak jeziora, stawy oraz wolno płynące rzeki. Preferuje środowiska z obfitą roślinnością wodną, która zapewnia schronienie oraz sprzyja rozmnażaniu. Gatunek ten pełni rolę drapieżnika, polując na drobne bezkręgowce wodne zarówno w stadiach dorosłych osobników, jak i larw, które również są aktywnymi drapieżnikami. Rozwój larwalny odbywa się w wodzie, co wpływa na regulację populacji innych organizmów w ekosystemie wodnym.
Agabus clypealis jest ważnym wskaźnikiem jakości środowiska wodnego, a jego obecność świadczy o czystości i dobrej kondycji zbiorników wodnych.

18. Sichrawa karpacka. (Pseudogaurotina excellens)
Gatunek Pseudogaurotina excellens został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2016 r. Gatunek Pseudogaurotina excellens znajduje się na liście gatunków zagrożonych/
opis
Gatunek rzadki i lokalny, endemiczny dla Karpat. W Polsce występuje głównie w rejonach Babiej Góry, Tatr i Pienin. Zasiedla górskie lasy iglaste, buczyny, zarośla, polany oraz piętro kosodrzewiny. Preferuje prześwietlone tereny o podłożu wapiennym.
- Wymiary: Długość ciała wynosi 13–17 mm.
- Aktywność: Imagines są aktywne od maja do sierpnia.
- Lokalizacja: W Polsce najliczniejsza populacja występuje w pasmie Babiogórskim.
- Pokarm: Dorosłe osobniki prawdopodobnie odżywiają się pyłkiem kwiatów wiciokrzewów, choć brakuje bezpośrednich obserwacji tego zachowania. Larwy rozwijają się w pędach wiciokrzewów, często w pobliżu szyjki korzeniowej, preferując wiciokrzew czarny (Lonicera nigra).
- Podobne gatunki: Gatunek można pomylić z pospolitą Gaurotes virginea, która jednak ma czerwony spód odwłoka.
zasięg geograficzny
Pseudogaurotina excellens to niezwykle rzadki gatunek reliktowy z okresu polodowcowego, endemiczny dla Karpat, występujący na Słowacji, w Polsce, zachodniej Ukrainie i Rumunii.
Wiele stanowisk tego gatunku odnotowano w Niżnych Tatrach, gdzie jest on jednak bardzo rzadki. Wcześniejsze doniesienia o występowaniu na Węgrzech okazały się błędne, wynikające z nieprawidłowej interpretacji lokalizacji typu „Thale Vratna”, która obecnie znajduje się na północy Słowacji, między miastami Martin i Žilina. Z tego powodu gatunek ten nie jest notowany na Węgrzech.
Szacowany zasięg występowania (EOO) Pseudogaurotina excellens w Europie wynosi około 142 768 km², podczas gdy obszar zajętości (AOO) to około 260 km². W granicach Unii Europejskiej (UE) zasięg występowania (EOO) wynosi około 131 309 km², a obszar zajętości (AOO) około 208 km². Gatunek ten ma zatem ograniczony zasięg i zajmuje stosunkowo niewielkie obszary, co podkreśla jego rzadkość i
podatność na zagrożenia.
populacja
Trend populacji Pseudogaurotina excellens jest trudny do określenia, ponieważ gatunek ten jest zawsze opisywany jako niezwykle rzadki, mimo licznych doniesień o jego lokalizacjach. Prawdopodobnie występuje on w krajobrazie w bardzo niskim zagęszczeniu, a jego biologii i zwyczaje utrudniają obserwację. Istnieją doniesienia sugerujące znaczący spadek liczebności populacji tego gatunku.
Na poziomie globalnym spadek ten jest bardzo prawdopodobny, co wskazuje, że obecny trend populacji może nadal maleć. Znane stanowiska gatunku są od siebie znacznie oddalone, co uniemożliwia naturalną ponowną kolonizację utraconych obszarów. Większość subpopulacji jest mała, odizolowana i narażona na wyginięcie, przy czym szanse na ich odtworzenie są minimalne. W związku z tym populacje Pseudogaurotina excellens uważa się za poważnie rozdrobnione zarówno w Europie, jak i w Unii Europejskiej.
habitat i ekologia
seudogaurotina excellens zamieszkuje otwarte lasy górskie, leśne pastwiska oraz łąki. Gatunek ten jest ściśle związany z krzewami wiciokrzewu (Lonicera), w szczególności z Lonicera nigra i Lonicera tatarica, które służą jako rośliny żywicielskie. Nie występuje w gęstych, zacienionych lasach, preferując natomiast krzewy rosnące na łąkach i na skrajach lasów. Larwy rozwijają się pod korą żywych gałęzi, chronione jedynie cienką warstwą zewnętrznej kory.
W ostatnim stadium rozwoju larwy drążą głębokie korytarze w drewnie, żywiąc się tkankami wytwarzanymi przez drzewo w odpowiedzi na uszkodzenia. Proces przepoczwarczenia następuje wiosną po dwu- lub trzyletnim okresie rozwoju larwalnego. Dorosłe osobniki pojawiają się w czerwcu i lipcu, przebywając wyłącznie na roślinach żywicielskich, nie odwiedzając kwiatów. Prawdopodobnie mają ograniczone zdolności lotu. Wśród naturalnych wrogów gatunku odnotowano trzy gatunki pasożytniczych błonkówek z rodziny Ichneumonidae.
zagrożenie
Pseudogaurotina excellens to niezwykle rzadki gatunek chrząszcza, będący reliktem epoki polodowcowej i endemiczny dla Karpat. Jest ściśle związany z drewnem krzewów z rodzaju Lonicera (wiciokrzew), występując głównie w otwartych lasach i zalesionych łąkach. Gatunek ten jest klasyfikowany jako zagrożony ze względu na ograniczony zasięg występowania (obszar zajmowany, AOO, wynosi około 260 km² w Europie i 208 km² w UE 28), silnie rozdrobnioną populację oraz prawdopodobny ciągły spadek jakości i zasięgu siedlisk, a także liczby subpopulacji.
Głównymi zagrożeniami są zmiany w użytkowaniu gruntów, w szczególności zaprzestanie wypasu bydła, które przyczyniało się do utrzymania otwartych lasów sprzyjających rozwojowi Lonicera. Dodatkowo, zbieranie chrząszczy przez kolekcjonerów, nawet na obszarach chronionych, stanowi poważne zagrożenie, podobnie jak rozwój infrastruktury narciarskiej w Karpatach, który może prowadzić do niszczenia lokalnych siedlisk.
Pseudogaurotina excellens jest objęty ochroną prawną na Słowacji, Ukrainie i w Polsce, a także uznany za gatunek priorytetowy w ramach Europejskiej Dyrektywy Siedliskowej. Mimo to, konieczne są dalsze badania nad dynamiką populacji, wpływem zmian w zarządzaniu lasami oraz interakcjami między Lonicera a praktykami wypasu.
Obszary chronione powinny uwzględniać specyficzne wymagania tego gatunku w swoich planach zarządzania. W obliczu postępujących zmian w krajobrazie i użytkowaniu gruntów, a także presji ze strony kolekcjonerów, istnieje wysokie ryzyko dalszego spadku liczebności populacji, zasięgu występowania i jakości siedlisk tego unikalnego chrząszcza.

19. Vit Örtblomfluga (Cheilosia alba)
Gatunek Vit Örtblomfluga Cheilosia alba został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2020 r. Cheilosia alba znajduje się na liście gatunków zagrożonych.
populacja
W całym znanym zasięgu występowania tego gatunku zaobserwowano tylko kilka osobników. Obecny trend populacji zarówno w Europie, jak i w UE jest nieznany. Z Włoch pochodzi tylko jeden lub dwa okazy, co sugeruje, że jest on tam bardzo rzadki. Większość zapisów z południowej Finlandii pochodzi z siedlisk w pobliżu zbiorników wodnych, takich jak jeziora czy strumienie.
Gatunek może być niedoszacowany z powodu wczesnego okresu lotu. Populacja jest poważnie rozdrobniona, a całkowitą liczbę zarejestrowanych osobników szacuje się na mniej niż 100, opierając się na dostępnych obserwacjach. W każdym z krajów, w obrębie obszaru występowania, jego obecność jest wysoce nieprzewidywalna, ponieważ jest rzadko spotykany, mimo wielokrotnych poszukiwań w znanych lokalizacjach na przestrzeni lat.
Siedlisko i ekologia
Gatunek ten występuje w wilgotnych lasach bukowych (Fagus), jodłowych (Abies) oraz świerkowych (Picea), aluwialnych (tj. lasy rosnące wzdłuż rzek i potoków, które są okresowo zalewane wodą, typowe dla terenów aluwialnych, czyli terenów, które zostały ukształtowane przez osady naniesione przez wodę). lasach iglastych z wierzby białej (Salix alba) oraz wilgotnych, mezofilnych/wapnofilnych lasach świerkowych (Picea). Dorosłe osobniki spotykane są wzdłuż strumieni w lasach, a także w pobliżu jezior lub rzek.
Wczesny okres lotu tego gatunku przypada na koniec marca do początku czerwca. Roślina żywicielska oraz stadia rozwojowe tego gatunku pozostają nieopisane, jednak przypuszcza się, że jest on fitofagiczny, podobnie jak inne, spokrewnione z nim gatunki.
zagrożenie
Gatunek ten jest oceniany jako zagrożony z powodu małego obszaru występowania (AOO), który wynosi 64 km² w Europie i 44 km² w UE27, poważnie rozdrobnionej populacji oraz prognozowanego pogorszenia jakości siedliska wskutek intensywnego użytkowania gruntów, w tym urbanizacji oraz gospodarki leśnej, w tym wycinki drzew, co może prowadzić do degradacji siedlisk.
Zasięg występowania (EOO) w Europie i UE wynosi 1 819 890 km². Gatunek ten występuje w wilgotnych lasach Fagus (buk), Abies (jodła) i Picea (świerk), aluwialnych lasach iglastych z Salix alba (wierzba biała) oraz w wilgotnych, mezofilnych/wapniofilnych lasach Picea (świerk).
Jest to gatunek bardzo rzadko spotykany we wszystkich krajach, w których występuje, takich jak Francja, Niemcy, Włochy, Finlandia, Czarnogóra i Norwegia. W każdym z tych krajów jego obecność jest trudna do przewidzenia, ponieważ jest rzadko spotykany, mimo licznych poszukiwań w znanych lokalizacjach w różnych latach.
Gatunek ten może być narażony na lokalne zagrożenia wynikające z działalności człowieka w Europie, w tym intensywnego użytkowania gruntów spowodowanego wzrostem urbanizacji i gospodarki leśnej, w tym wycinkami, co może prowadzić do degradacji siedlisk. Lasy bukowe Fagus zostały znacząco zredukowane w całej Europie, co może mieć wpływ na ten gatunek. Ponadto, gatunek ten może być wrażliwy na niszczenie naturalnych siedlisk w pobliżu strumieni lub innych małych zbiorników wodnych. Na Bałkanach budowa zapór wodnych stanowi potencjalne zagrożenie.
W Serbii gatunek jest znany tylko z jednej lokalizacji, która najprawdopodobniej wyginęła, ponieważ siedlisko zostało zniszczone przez wylesianie. Nie odnotowano go w tej lokalizacji przez ostatnie siedem lat, mimo ukierunkowanych badań. Nie jest do końca jasne, czy wylesianie prowadzi do utraty siedliska lub jego degradacji, ponieważ roślina żywicielska tego gatunku pozostaje nieznana.

20. Węglarek klonowy (Ropalopus ungaricus)
Ropalopus ungaricus został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2009 r. Ropalopus ungaricus znajduje się na liście gatunków zagrożonych.
opis
Ropalopus ungaricus to średniej wielkości chrząszcz z rodziny kózkowatych (Cerambycidae), osiągający 10–20 mm długości. Charakteryzuje się smukłą i wydłużoną sylwetką.
- Przedplecze – czarne, matowe, o lekko zaokrąglonych bokach, pokryte delikatnym punktowaniem.
- Pokrywy – czarne, drobno pomarszczone, z wyraźnym, metalicznym połyskiem, który może przybierać odcienie fioletowe, niebieskie, zielonkawe lub miedziane.
- Nogi – czarne i smukłe, przystosowane do wspinaczki po korze drzew.
- Czułki – długie i cienkie, również czarne; u samców wyraźnie dłuższe niż u samic.
Jest to gatunek ściśle związany z klonami, a jego wygląd sprawia, że doskonale wtapia się w strukturę kory drzew.
zasięg geograficzny
Ten gatunek jest endemiczny dla Europy i szeroko rozpowszechniony w Europie Środkowej i Wschodniej.
Na Węgrzech występuje bardzo rzadko, głównie w pagórkowatych i niższych regionach górskich. We Francji zasiedla północno-wschodnie obszary kraju, w tym Alzację, Jurę i Rodan-Alpy, nie pokrywając się z zasięgiem R. insubricus. W Niemczech jego obecność odnotowano po 1950 roku w Badenii-Wirtembergii, Bawarii i Nadrenii Północnej-Westfalii, a starsze zapisy wskazują na występowanie w Saksonii-Anhalt, Turyngii i Saksonii. W Szwajcarii uznany jest za gatunek wymarły.
populacja
Gatunek ten jest rzadki w całym swoim zasięgu i występuje w rozproszonych populacjach.
Na Ukrainie jest stosunkowo rzadki, podobnie jak na Węgrzech, gdzie jego liczebność i tendencje populacyjne nie zostały dokładnie określone. We Francji, mimo dużego obszaru występowania, pozostaje gatunkiem rzadkim. We Włoszech odnotowano 30 lokalnych populacji w części kontynentalnej. W Rumunii istnieje jedynie pojedynczy zapis sprzed 1900 roku.
Siedlisko i ekologia
Gatunek ten jest obligatoryjnie saproksyliczny, co oznacza, że jego rozwój jest ściśle związany z martwym lub rozkładającym się drewnem. Larwy rozwijają się pod korą obumierających lub martwych gałęzi i pni drzew liściastych, szczególnie klonów (Acer), a rzadziej również figowców (Ficus), jesionów (Fraxinus), olch (Alnus), buków (Fagus), wierzb (Salix) i innych. Przepoczwarczają się w drewnie, preferując grube, solidne drzewa.
Dorosłe osobniki pojawiają się od czerwca do sierpnia i można je spotkać na roślinach żywicielskich. Chrząszcz preferuje samotne drzewa lub otwarte skupiska drzew, zwłaszcza na skrajach lasów i zagajników. Szczególnie ważne dla jego bytowania są stare drzewa ogłowione i inne drzewa charakterystyczne dla tradycyjnego krajobrazu kulturowego, które odgrywają istotniejszą rolę niż drzewa rosnące w gęstych lasach.
Na Węgrzech gatunek występuje w starych, nienaruszonych lasach z obecnością wiekowych klonów. W Czechach preferuje otwarte skupiska drzew i nie toleruje zacienienia. We Francji larwy, będące ksylofagami (odżywiającymi się drewnem), rozwijają się na klonie jaworze (Acer pseudoplatanus), wykorzystując pnie, duże gałęzie oraz odsłonięte korzenie.
Sytuacja Ropalopus ungaricus w Polsce
Ropalopus ungaricus, czyli węglarek klonowy, to gatunek chrząszcza z rodziny kózkowatych (Cerambycidae), który w Polsce uważany jest za gatunek skrajnie rzadki i niepotwierdzony od wielu lat. Historycznie był notowany na dwóch stanowiskach:
- Puszcza Białowieska – dwa osobniki zostały zebrane w XIX wieku.
- Rezerwat “Bielinek” nad Odrą – pojedynczy okaz znaleziony w latach 20. XX wieku.
Oba te stanowiska należą do najbardziej wysuniętych na północ w jego europejskim zasięgu. Brak nowych potwierdzonych obserwacji sugeruje, że gatunek może być wymarły w Polsce lub występować w liczbie tak małej, że trudno go wykryć.
Zagrożenia
- Utrata odpowiednich siedlisk – Ropalopus ungaricus jest związany ze starymi klonami (Acer spp.), które są coraz rzadziej spotykane w krajobrazie Polski.
- Zmiany w leśnictwie – usuwanie martwych i zamierających drzew, brak starych drzewostanów.
- Fragmentacja populacji – nawet jeśli pojedyncze osobniki wciąż występują, ich izolacja uniemożliwia odbudowę licznej populacji.
Ze względu na brak nowych stwierdzeń i wyraźne zagrożenia, gatunek ten w Polsce uznaje się za prawdopodobnie wymarły (RE) lub krytycznie zagrożony (CR), wymagający dalszych badań terenowych.
Zagrożenia
Gatunek ten jest zagrożony głównie przez zacienienie siedlisk oraz zanikanie tradycyjnych metod gospodarowania krajobrazem.
Na Węgrzech kluczowym problemem jest utrata siedlisk, spowodowana usuwaniem starych klonów z lasów, co bezpośrednio przyczynia się do rzadkości tego gatunku. We Francji zagrożeniem jest zmniejszająca się liczba starych klonów, zwłaszcza w żywopłotach krajobrazu rolniczego oraz w lasach, co ogranicza dostępność odpowiednich miejsc do rozwoju larw i bytowania dorosłych osobników.
Grzyby

1. Cystoderma carpaticum
Gatunek Cystoderma carpaticum został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2019 r. Cystoderma carpaticum znajduje się na liście gatunków zagrożonych.
Cystoderma carpaticum to rzadki gatunek grzyba z rodziny Agaricaceae, opisany po raz pierwszy w 1979 roku. Występuje wyłącznie w Europie, w regionach o klimacie kontynentalnym, i jest znany z kilku stanowisk w Polsce i Chorwacji.
opis:
- Owocniki: Cystoderma carpaticum tworzy niewielkie owocniki o kapeluszach osiągających średnicę do kilku centymetrów. Kapelusze są początkowo wypukłe, a z czasem stają się płaskie lub lekko wklęsłe. Ich powierzchnia jest sucha, pokryta drobnymi łuseczkami, a kolor może wahać się od jasnobrązowego do czerwonobrązowego.
- Blaszki: Blaszki są gęste, początkowo białe, z czasem stają się kremowe lub jasnobrązowe.
- Trzon: Trzon jest smukły, zwężający się ku górze, pokryty drobnymi łuskami. Może mieć podobny kolor do kapelusza lub być nieco jaśniejszy.
- Zarodniki: Zarodniki są gładkie, elipsoidalne i bezbarwne.
zasięg geograficzny
Cystoderma carpaticum to rzadki gatunek grzyba, znany wyłącznie z Europy. Jego występowanie zostało potwierdzone tylko w dwóch krajach: Polsce i Chorwacji. W Polsce gatunek ten odnotowano w dwóch pobliskich lokalizacjach w Bieszczadzkim Parku Narodowym, w paśmie Karpat. W Chorwacji występuje w Parku Przyrody Žumberak-Samoborsko gorje oraz w dziewiczym lesie Čorkova uvala w Parku Narodowym Jezior Plitwickich. Istnieje również niepotwierdzone doniesienie o występowaniu tego gatunku na Słowacji, w Kraju Preszowskim, jednak brakuje okazów, które mogłyby potwierdzić ten zapis.
Wcześniejsze doniesienia o występowaniu Cystoderma carpaticum w Austrii i Czechach okazały się błędne – zidentyfikowane okazy należały do gatunku Cystoderma subvinaceum.
Podsumowując, Cystoderma carpaticum to gatunek o bardzo ograniczonym zasięgu, którego przetrwanie zależy od ochrony starych lasów bukowych oraz dalszych badań mających na celu odkrycie potencjalnych, nieznanych stanowisk.
Szacuje się, że Cystoderma carpaticum występuje w pięciu lokalizacjach w Polsce, pięciu w Chorwacji oraz w maksymalnie 10 nieodkrytych lokalizacjach w kontynentalnych częściach Europy Wschodniej. W każdej lokalizacji populacja składa się prawdopodobnie z około 10 dojrzałych osobników. Na podstawie tych danych całkowitą populację gatunku szacuje się na mniej niż 200 dojrzałych osobników, co kwalifikuje go do kategorii zagrożony (EN) według kryterium D IUCN.
Gatunek ten jest ściśle związany z naturalnymi, starymi lasami bukowymi, występującymi w regionach o klimacie kontynentalnym. Szacuje się, że Cystoderma carpaticum występuje w pięciu lokalizacjach w Polsce, pięciu w Chorwacji oraz w maksymalnie 10 nieodkrytych lokalizacjach w kontynentalnych częściach Europy Wschodniej. W każdej lokalizacji populacja składa się prawdopodobnie z około 10 dojrzałych osobników. Na podstawie tych danych całkowitą populację gatunku szacuje się na mniej niż 200 dojrzałych osobników, co kwalifikuje go do kategorii zagrożony (EN).
siedlisko i ekologia
Cystoderma carpaticum to gatunek grzyba rozkładającego drewno, który występuje jesienią na silnie rozłożonym drewnie bukowym (Fagus sylvatica), zarówno na martwych stojących drzewach, jak i powalonych kłodach. Gatunek ten został odnotowany w kilku europejskich lasach pierwotnych, zlokalizowanych w regionach o klimacie kontynentalnym.
Cystoderma carpaticum występuje w naturalnych, starych lasach bukowych, często w towarzystwie jodły (Abies alba) i świerka (Picea abies). Preferuje miejsca z dużą ilością martwego drewna, zarówno stojącego, jak i leżącego. Gatunek ten jest wskaźnikiem lasów o wysokim stopniu naturalności i występuje głównie w obszarach chronionych, takich jak parki narodowe i rezerwaty.
Trzy znane stanowiska Cystoderma carpaticum (jedno w Chorwacji i dwa w Polsce) znajdują się w naturalnych lasach bukowych. Czwarte stanowisko w Chorwacji obejmuje mieszany las pierwotny, w którym obok buka występują jodła (Abies alba) i świerk (Picea abies). Wszystkie stanowiska charakteryzują się obecnością starych drzew, martwych stojących drzew oraz powalonych kłód, co tworzy idealne warunki dla rozwoju tego rzadkiego grzyba.
zagrożenia
Choć możliwe, że liczba nieodkrytych lokalizacji jest większa, a populacja liczniejsza, to prawdopodobieństwo, że wszystkie te stanowiska znajdują się na obszarach chronionych, jest niskie. W takim przypadku gatunek nadal kwalifikowałby się jako zagrożony, zgodnie z kryterium C IUCN. W Europie jedynie 4% lasów pozostaje niezakłóconych przez działalność człowieka (FOREST EUROPE 2015), co dodatkowo zwiększa ryzyko dla tego gatunku.
Cystoderma carpaticum jest niezwykle rzadkim gatunkiem, ograniczonym do starych, naturalnych lasów bukowych. Wszystkie znane stanowiska znajdują się w europejskich lasach dziewiczych o charakterze kontynentalnym. Zakłada się, że obecne populacje są względnie stabilne, ponieważ występują na obszarach chronionych (parkach narodowych i rezerwatach). Jednak potencjalnymi zagrożeniami są zmiany w zarządzaniu lasami, wycinka sanitarna, nielegalna wycinka oraz fragmentacja siedlisk.
Cystoderma carpaticum jest związany wyłącznie ze starymi lasami bukowymi, zarówno jednogatunkowymi, jak i mieszanymi (z jodłą i świerkiem). Rośnie na bardzo rozłożonym drewnie bukowym, zarówno na martwych stojących drzewach, jak i leżących kłodach. Podejrzewa się, że gatunek ten może występować również w innych regionach Europy Wschodniej, takich jak Bałkany, Karpaty czy Rosja, gdzie lasy bukowe są często słabo zbadane. Jednak lasy te są obecnie zagrożone z powodu nielegalnej i komercyjnej wycinki, co może prowadzić do dalszego spadku populacji tego gatunku.
Istnieje duże prawdopodobieństwo, że w Europie Wschodniej, szczególnie w Karpatach i na Bałkanach, występują nieodkryte populacje tego gatunku. Jednak lasy te są często niezmapowane i niechronione, a ich powierzchnia zmniejsza się w alarmującym tempie z powodu nielegalnej i komercyjnej wycinki (np. w Rumunii). Typ siedliska, jakim jest kontynentalny las bukowy Luzulo-Fagetum, jest wymieniony jako niekorzystny-nieodpowiedni w załączniku I Dyrektywy Siedliskowej (kod 9110).
Podsumowując, Cystoderma carpaticum to gatunek zagrożony, którego przetrwanie zależy od ochrony starych lasów bukowych oraz zapobiegania ich degradacji i fragmentacji. Konieczne są dalsze badania i monitoring, aby lepiej zrozumieć rozmieszczenie i stan populacji tego rzadkiego grzyba.

2. Jamkóweczka cytrynowa. Lemon-coloured Antrodiella (Flaviporus citrinellus)
Gatunek Antrodiella Flaviporus citrinellus o cytrynowym kolorze został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2019 r. Flaviporus citrinellus jest wymieniony jako gatunek zagrożony.
opis
Owocnik
- Kształt: Poliporoidalny (półkowaty), jednoroczny, rozpostarty lub bardzo wąsko odgięty, przyrośnięty do podłoża.
- Wymiary: 2–7 cm długości i 1–2 cm szerokości.
- Konsystencja: W stanie świeżym elastyczny i twardy, w stanie suchym korkowaty.
- Kapelusz: Jeśli występuje, wystaje do 2 mm. Jego górna powierzchnia jest matowa, aksamitna, o słomkowym kolorze, z ostro ograniczonym brzegiem.
- Powierzchnia porów: Blada do jasno cytrynowożółtej, w stanie suchym nieco blednąca.
- Pory: Okrągłe, niektóre lekko wydłużone, 3–4 (czasem 5) na mm. Ściany porów są drobno ząbkowane.
- Kontekst: Twardo-włóknisty, biały do słomkowego, o grubości 0,5 mm. Warstwa rurek ma grubość 1 mm i jest tego samego koloru co kontekst.
Cechy mikroskopowe
- System strzępkowy: Dimityczny (składa się z dwóch rodzajów strzępek).
- Strzępki generatywne: Zawierają sprzążki, o szerokości 2–4 μm.
- Strzępki szkieletowe: Dominujące, grubościenne lub lite, bez przegród, o szerokości 2–5 μm. W odczynniku Melzera mają wyraźne światło.
- Hymenium: Brak cystyd i innych płonnych elementów.
- Podstawki: 10–12 × 4–5 μm, maczugowate, z czterema sterygmami i sprzążkami bazalnymi.
- Bazydiospory: 3–3,5 × 2–2,5 μm, szkliste, prawie kuliste, gładkie, cienkościenne. W odczynniku Melzera nieamyloidalne, z dużą gutulą (kroplą tłuszczu).
- System strzępkowy: Dimityczny (składa się z dwóch rodzajów strzępek).
zasięg geograficzny
Flaviporus citrinellus to gatunek grzyba, który jest endemitem europejskim. Występuje wyłącznie w starych lasach jodłowych lub świerkowo-jodłowych, gdzie rośnie na dużych, grubych szczątkach drewna.
Lokalizacje występowania
- Finlandia: 130 stanowisk.
- Federacja Rosyjska: 100 stanowisk.
- Norwegia: 66 stanowisk.
- Czechy: 31 stanowisk.
- Estonia: 29 stanowisk.
- Szwecja: 25 stanowisk.
- Szwajcaria: 13 stanowisk.
- Niemcy: 7 stanowisk.
- Litwa: 4 stanowiska.
- Słowacja: 4 stanowiska.
- Austria: 3 stanowiska.
- Bośnia i Hercegowina: 1 stanowisko.
- Chorwacja: 1 stanowisko.
- Francja: 1 stanowisko.
- Polska: 1 stanowisko.
populacja
Flaviporus citrinellus to gatunek grzyba, którego dojrzałe osobniki są bardzo rzadkie. Na podstawie danych z GBIF i innych dostępnych baz danych znanych jest 500 lokalizacji na całym świecie, a globalna szacunkowa liczba stanowisk wynosi 750. Liczbę dojrzałych osobników oszacowano na 3000.
- Preferowane siedliska: Gatunek ten występuje wyłącznie w lasach pierwotnych z dużą ilością dużych, grubych szczątków drewna.
- Spadek siedlisk: Ten typ lasu jest w znacznym zaniku w całym regionie, co prowadzi do spadku liczebności populacji F. citrinellus.
siedlisko i ekologia
Flaviporus citrinellus to rzadki, jednoroczny grzyb hubkowy, który rośnie na drewnie, powodując białą zgniliznę. Występuje głównie na świerku pospolitym (Picea abies) i jodle pospolitej (Abies alba), znacznie rzadziej na drzewach liściastych z rodziny bukowatych (Fagaceae). Preferuje lasy pierwotne z dużą ilością dużych, grubych szczątków drewna.
związek z innymi gatunkami
- Pasożytnictwo: Gatunek ten jest często związany z Fomitopsis pinicola (hubiak pospolity), na którym pasożytuje.
- Cykl owocnikowania: Podczas gdy Fomitopsis pinicola owocuje przez cały rok, F. citrinellus rozwija owocniki głównie późną jesienią (październik, listopad) i wiosną (kwiecień–czerwiec).
siedlisko
- Lokalizacja: Występuje na zboczach wzgórz i gór oraz w dolinach rzek lub strumieni w podmokłych lasach świerkowych i lasach wąwozowych.
- Wysokość: Większość stanowisk znajduje się w górskich i nadgórskich lasach świerkowych (1000–1300 m n.p.m.) oraz w podgórskich i górskich lasach mieszanych zdominowanych przez buk, świerk i jodłę. W Szwajcarii i Polsce gatunek ten występuje również na nizinach poniżej 600 m n.p.m.
- Substrat: Owocniki rozwijają się głównie na powalonych pniach o średnicy 10–100 cm, rzadziej na stojących drzewach.
znaczenie ekologiczne
- Gatunek wskaźnikowy: F. citrinellus jest ważnym gatunkiem wskaźnikowym dla górskich lasów pierwotnych. Powinien być brany pod uwagę przy wyznaczaniu obszarów chronionych.
- Zagrożenia: Lasy pierwotne, w których występuje ten gatunek, są silnie zagrożone wycinką i zmianami w zarządzaniu. Na przykład w Austrii tylko 3% lasów to lasy dziewicze.
trudności w obserwacji
- Ukryte owocniki: Owocniki F. citrinellus są dość ukryte i trudne do znalezienia.
- Wzrost liczby raportów: Ostatni wzrost liczby doniesień o tym gatunku wynika ze zwiększonej świadomości i zainteresowania ze strony mykologów.
zagrożenia
Flaviporus citrinellus to gatunek grzyba, który jest endemitem europejskim. Występuje wyłącznie w starych lasach jodłowych lub świerkowo-jodłowych, gdzie rośnie na dużych, grubych szczątkach drewna. Gatunek ten jest zagrożony w całym swoim zasięgu z powodu niszczenia siedlisk, zmian w zarządzaniu lasami oraz wpływu zmian klimatycznych.
Główne zagrożenia
- Niszczenie siedlisk:
- Wycinka lasów i zmiany w zarządzaniu lasami prowadzą do utraty odpowiednich siedlisk.
- Tylko 3% lasów w Austrii to lasy dziewicze, które są kluczowe dla przetrwania tego gatunku.
- Zmiany klimatyczne:
- Optymalny wzrost Flaviporus citrinellus występuje w niskich temperaturach (5–10 °C), co sprawia, że jest wrażliwy na ocieplenie klimatu.
Status ochrony
- Czerwone Listy: Gatunek jest wymieniony na Czerwonych Listach w 9 krajach, głównie jako zagrożony (EN) lub krytycznie zagrożony (CR).

3. Pniarek lekarski. Agarikon. Eburiko (Fomitopsis officinalis)
Eburiko Fomitopsis officinalis został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2019 r. Fomitopsis officinalis jest wymieniony jako gatunek zagrożony
Klasyfikacja naukowa Laricifomes officinalis:
- Domena: Eukaryota (eukarionty)
- Królestwo: Fungi (grzyby)
- Typ: Basidiomycota (podstawczaki)
- Klasa: Agaricomycetes
- Rząd: Polyporales (żagwiowce)
- Rodzina: Laricifomitaceae
- Rodzaj: Laricifomes
- Gatunek: Laricifomes officinalis
opis
Charakterystyczne owocniki Fomitopsis officinalis można znaleźć wyrastające z boku lub zwisające z gałęzi drzewa żywicielskiego, nawet na wysokości do 20 metrów (65 stóp) nad ziemią.
Owocniki te przybierają kształt kopyt lub kolumn, niekiedy osiągając ponad 65 centymetrów (2 stopy) długości i prawie 40 centymetrów (1,5 stopy) obwodu, a ich waga może dochodzić do 9 kilogramów (20 funtów).
Młode owocniki są miękkie i mają żółtobiałe zabarwienie, ale szybko twardnieją, stając się kredowobiałe. W miarę starzenia się zmieniają kolor, przybierając odcienie czerwieni, brązu lub szarości, a na ich powierzchni pojawiają się charakterystyczne sześcienne pęknięcia, w których widoczne są grube, białe włókna.
Zarodniki są białe, elipsoidalne i uwalniane są przez spód owocnika w cieplejszych miesiącach. Zarówno owocniki, jak i ich włóknista struktura mają gorzki smak i łagodny, mączny zapach.
Podobne gatunki
Fomitopsis officinalis może być mylony z przedstawicielami rodzaju Phellinus, które jednak są ciemniejsze (czarniawe) i preferują drzewa liściaste. Podobne mogą być również gatunki z rodzaju Fomitopsis mounceae oraz jego krewni, a także Ganoderma brownii.
zasięg geograficzny
Fomitopsis officinalis to gatunek o holarktycznym zasięgu, co oznacza, że występuje na obszarach półkuli północnej, obejmujących Europę, Azję, Amerykę Północną oraz północną Afrykę. Jego rozmieszczenie ma charakter głównie górski, hipoarktyczny i borealny, co wskazuje, że zasiedla tereny górskie, chłodne regiony subarktyczne oraz lasy borealne (tajgę).
W Ameryce Północnej gatunek ten występuje przede wszystkim na północno-zachodnim wybrzeżu Pacyfiku. W Europie zasiedla głównie obszary górskie, a także Ural. W Azji jego zasięg obejmuje Syberię, Daleki Wschód, Chiny, Mongolię, Japonię, Koreę oraz Indie. W Afryce spotykany jest wyłącznie w górach Atlas w Maroku.
Rozmieszczenie Fomitopsis officinalis pokrywa się mniej więcej z występowaniem drzew z rodzaju Larix (modrzew) w Eurazji oraz z Larix, Pseudotsuga (daglezja) i niektórymi gatunkami Picea (świerk) w Ameryce Północnej. Oznacza to, że gatunek ten jest ściśle związany z tymi drzewami, które stanowią jego główne siedliska.
Wyjaśnienie terminów naukowych:
- Holarktyczny: odnoszący się do obszarów półkuli północnej, obejmujących Europę, Azję, Amerykę Północną i północną Afrykę.
- Hipoarktyczny: dotyczący chłodnych regionów położonych na południe od strefy subarktycznej.
- Borealny: związany z lasami borealnymi (tajgą), które charakteryzują się chłodnym klimatem i dominacją drzew iglastych.
- Larix spp.: skrót oznaczający różne gatunki modrzewia.
- Pseudotsuga: rodzaj drzew iglastych, do którego należy m.in. daglezja.
- Picea: rodzaj drzew iglastych, obejmujący świerki.
populacja
Fomitopsis officinalis znacznie zmniejszył swoją populację w ciągu ostatnich stuleci. Liczne doniesienia z różnych krajów i kontynentów wskazują na ciągły spadek liczebności tego gatunku oraz kurczenie się jego siedlisk w porównaniu z pierwszą połową XX wieku.
Przykłady tego spadku obejmują:
- W Kolumbii Brytyjskiej (Kanada) odnotowano 109 stanowisk Fomitopsis officinalis od 1940 roku, jednak tylko 19 z nich zostało dodanych w ciągu ostatnich 20 lat. Nie jest jasne, czy zmniejszona liczba obserwacji wynika z utraty siedlisk, w tym z zaniku starych drzew.
- W północnym Wisconsin (USA) na początku XX wieku gatunek ten był opisywany jako występujący na modrzewiu (Larix), jednak obecnie nie jest już uważany za obecny na Środkowym Zachodzie Stanów Zjednoczonych.
- W Polsce do XVIII wieku Fomitopsis officinalis był dość powszechny, a w niektórych regionach nawet bardzo liczny. Jednak w XX wieku został niemal całkowicie wytępiony, a obecnie znanych jest tylko sześć jego stanowisk.
- W azjatyckiej części Rosji gatunek ten stał się rzadki. Przez 26 lat badań odnotowano go zaledwie 46 razy na 26 stanowiskach. Na przykład w Ałtaju na początku XX wieku około 10% modrzewi (Larix) było zainfekowanych przez ten grzyb, podczas gdy w 2001 roku znaleziono go tam tylko raz.
- W obwodzie irkuckim i Republice Buriacji (Rosja) gatunek ten był niegdyś dość powszechny, ale intensywne zbieranie go w celach leczniczych (w tonach) doprowadziło do znacznego spadku jego populacji.
Obecna liczba znanych stanowisk w Europie zbliża się do 100, z czego 80% znajduje się w Alpach Francuskich i Szwajcarskich. Na Litwie i w Hiszpanii nie ma żadnych zapisów po 1968 roku.
We Francji, Polsce, Słowacji i Słowenii zauważono spadek w ciągu ostatnich 50 do 100 lat. Nieznaczny wzrost liczby stanowisk odnotowano w Szwajcarii, prawdopodobnie związany z zaprzestaniem zbieractwa i bardziej zrównoważoną gospodarką leśną. W Rosji około 50 stanowisk jest zarejestrowanych w źródłach naukowych, ale może występować na około 1000 lub nawet więcej stanowiskach. Jest szeroko rozpowszechniony, ale rzadki w zachodniej Ameryce Północnej.
W Japonii gatunek ten jest rzadki i występuje tylko w dojrzałych lasach modrzewiowych (Larix) lub świerkowych (Picea), zgłaszany z kilku miejsc, w tym prefektury Hokkaido, Shizuoka i Tochigi.
Gatunek ten znajduje się na krajowych Czerwonych Listach kilku krajów europejskich, np. Austrii, Francji, Niemiec, Litwy, Polski, Rosji (regionalne Czerwone Księgi), Słowacji i Szwajcarii. Jest prawnie chroniony w Niemczech, Litwie, Polsce i Słowenii. Został wymieniony jako zagrożony w Europie przez Dahlberga i Croneborga (2003).
Fomitopsis officinalis ma długowieczną grzybnię rosnącą w drewnie, a długość jego pokolenia może przekraczać 50 lat. Ocenia się, że jego populacja zmniejszyła się z powodu przeszłej i trwającej utraty siedlisk oraz ciągłych zbiorów, przy czym spadek przekroczył 50% w ciągu ostatnich trzech pokoleń. W Europie i Ameryce Północnej spadek ten był jeszcze większy. W związku z tym Fomitopsis officinalis jest oceniany jako zagrożony (EN) w skali globalnej.
Spadek populacji Fomitopsis officinalis jest wynikiem utraty siedlisk, wycinki starych drzew oraz intensywnego zbierania owocników do celów leczniczych. Gatunek ten wymaga pilnych działań ochronnych, aby zapobiec jego dalszemu zanikowi.
Siedlisko i ekologia
Fomitopsis officinalis to grzyb pasożytniczy, który atakuje drzewa, a po śmierci żywiciela kontynuuje życie jako saprotrof, rozkładając martwe drewno. Najczęściej występuje na różnych gatunkach modrzewia (Larix), rzadziej na daglezji (Pseudotsuga), jodle (Abies), sośnie (Pinus), świerku (Picea), choinie (Tsuga) i cedrze (Cedrus).
W Europie, z wyjątkiem Hiszpanii, gdzie odnotowano go na sośnie czarnej (Pinus nigra subsp. salzmannii), gatunek ten występuje wyłącznie na modrzewiach: Larix decidua, L. decidua var. polonica oraz L. sibirica.
W Azji zasiedla również L. gmelinii i L. cajanderii, a rzadziej sosnę syberyjską (Pinus sibirica) i sosnę zwyczajną (P. sylvestris). W Ameryce Północnej stwierdzono go na daglezji zielonej (Pseudotsuga menziesii), świerku sitkajskim (Picea sitchensis), sośnie żółtej (Pinus ponderosa) oraz modrzewiu zachodnim (Larix occidentalis).
Gatunek ten preferuje stare i grube drzewa, dlatego występuje głównie w naturalnych, pierwotnych lasach, szczególnie w rejonach górskich. Powoduje brunatną zgniliznę drewna. Jego wieloletnie owocniki (basidiokarpy) mogą żyć nawet 60–70 lat, osiągając rozmiary do 40 × 65 cm i wagę do 10 kg.
Owocniki pojawiają się na pniu drzewa żywicielskiego, od podstawy do wysokości ponad 20 metrów, rzadko na grubych gałęziach, zwykle w miejscu infekcji po kilku dekadach rozwoju grzyba. Fomitopsis officinalis może występować zarówno na żywych drzewach, jak i na martwych pniach.
W Europie gatunek ten jest związany głównie z naturalnymi, starodrzewowymi lasami modrzewiowymi w strefie subalpejskiej Alp, lasami modrzewiowymi w Górach Świętokrzyskich oraz nizinnymi lasami modrzewiowymi Europy Wschodniej.
Występuje niemal wyłącznie w lasach naturalnych, bardzo rzadko w plantacjach lub parkach. Najczęściej zasiedla drzewa osłabione stresem środowiskowym, takim jak nieoptymalne warunki siedliskowe, uszkodzenia mechaniczne lub obecność innych pasożytów grzybowych.
zagrożenia.
Fomitopsis officinalis to pasożytniczy grzyb rozwijający się na drewnie, tworzący charakterystyczne owocniki w kształcie kopyt lub kolumn, które mogą osiągać ponad 50 cm długości. Gatunek ten jest szeroko rozpowszechniony na półkuli północnej, występując głównie w subalpejskich, górskich lasach borealnych i hipoarktycznych, gdzie zasiedla duże i stare drzewa iglaste, takie jak modrzew (Larix).
Znany jest również pod nazwą Agarikon i od czasów starożytnych był zbierany do celów medycznych. Obecnie jest uznawany za gatunek rzadki lub niezwykle rzadki na całym świecie, a jego populacja znacząco zmniejszyła się w ciągu ostatnich stuleci.
Gatunek ten został sklasyfikowany jako zagrożony (EN) ze względu na 70–75% spadek populacji w przeszłości, spowodowany degradacją siedlisk, ich utratą oraz zbieraniem owocników (basidiokarpów) do celów leczniczych. Zakłada się, że spadek populacji będzie się utrzymywał, choć w wolniejszym tempie.
Główne zagrożenia dla Fomitopsis officinalis obejmują:
- Wycinanie lasów subalpejskich, górskich, borealnych i subarktycznych, w tym lasów modrzewiowych oraz pojedynczych starych drzew, zwłaszcza modrzewi (Larix spp.) i innych drzew iglastych (również w ramach regularnego zarządzania lasami i usuwania drzew zainfekowanych, uszkodzonych lub o niepożądanym kształcie).
- Zmiany w strukturze wiekowej i gatunkowej drzew w lasach, które wpływają na dostępność odpowiednich siedlisk.
- Degradację i utratę siedlisk związaną z działalnością gospodarczą, taką jak wycinka drzew, budowa obiektów turystycznych i sportowych.
- Zbieranie owocników do celów leczniczych, co dodatkowo zmniejsza szanse na rozmnażanie i przetrwanie gatunku.
Aby ochronić Fomitopsis officinalis, konieczne jest wdrożenie działań ochronnych, takich jak zachowanie starych drzew i naturalnych lasów, ograniczenie zbierania owocników oraz monitorowanie stanu populacji.
Wilgotnica żółta. Dottergelber Saftling. (Gloioxanthomyces vitellinus) Europejska Czerwona Lista. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Owady, grzyby, małże, ślimaki. Stan na 15 marca 2025 r
4. Wilgotnica żółta. Dottergelber Saftling. (Gloioxanthomyces vitellinus)
Gatunek Gloioxanthomyces vitellinus z Dottergelber Saftling został ostatnio oceniony pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2019 r. Gloioxanthomyces vitellinus jest wymieniony jako gatunek zagrożony
opis
Kapelusz
- Średnica: 1–3 cm.
- Kształt: U młodych okazów dzwonkowato-sklepiony, u starszych szerokorozpostarty.
- Brzeg: Nieregularnie falisty, czasami pofalowany, zazwyczaj prążkowany.
- Powierzchnia: Gładka i lepka.
- Barwa: Od cytrynowożółtej do chromowożółtej; podczas wysychania blednie do piaskowej, a nawet białawej.
Blaszki
- Kształt: Różnej długości, dość rzadkie, przy trzonie zbiegające.
- Brzeżki: Równe.
- Barwa: Od cytrynowożółtej do żółtopomarańczowej.
Trzon
- Wysokość: 3–5 cm.
- Średnica: 2–4 mm.
- Kształt: Cienki, wysmukły, kruchy, przeważnie prosty.
- Powierzchnia: Gładka i lepka; pod kapeluszem biaława, poza tym cytrynowożółta. Podczas wysychania blednie podobnie jak kapelusz.
Wysyp zarodników
- Barwa: Biały.
- Zarodniki: Eliptyczne, jajowate, o rozmiarach 6–8 × 4,5–5 μm.
Taksonomia w szczegółach
Gloioxanthomyces vitellinus to gatunek grzyba występujący w Europie, należący do nowego rodzaju Gloioxanthomyces. Jest blisko spokrewniony z północnoamerykańskim gatunkiem G. nitidus. Epityp (wzorcowy okaz) tego gatunku został wybrany ze Szwecji.
Występowanie i identyfikacja
- Ameryka Północna: Występowanie G. vitellinus w Ameryce Północnej, zgłoszone w bazie GBIF, prawdopodobnie dotyczy gatunku G. nitidum.
- Inne regiony: Wszystkie inne zgłoszenia poza Europą są wątpliwe i nie będą tutaj omawiane.
Pomyłki w identyfikacji
W niektórych krajach europejskich G. vitellinus bywa mylony z gatunkiem Chromosera (Hygrocybe) citrinopallida, który występuje głównie w regionach alpejskich. Gatunek ten różni się od G. vitellinus brakiem lepkiej lub śluzowatej krawędzi blaszek oraz zupełnie innym kształtem zarodników.
Ponadto w Europie Środkowej G. vitellinus bywa czasami błędnie identyfikowany jako Hygrocybe ceracea.
zasięg geograficzny
Gloioxanthomyces vitellinus to gatunek występujący wyłącznie w Europie. Jego największe populacje znajdują się w północno-zachodniej części kontynentu, szczególnie w Wielkiej Brytanii, Holandii, Niemczech, Szwecji, Danii i Norwegii. W pozostałej części zachodniej i środkowej Europy gatunek ten występuje bardziej rozproszony.
charakterystyka występowania
- Brak w Finlandii i większości wschodniej Europy: Gatunek nie występuje w Finlandii ani w większości regionów wschodniej Europy.
- Występowanie przybrzeżne: Wysoka częstotliwość występowania w obszarach Morza Północnego sugeruje, że G. vitellinus preferuje klimat oceaniczny, charakteryzujący się łagodnymi zimami i wysoką wilgotnością.
- Przykłady: W zachodniej Norwegii gatunek ten występuje głównie na wybrzeżu, gdzie średnie temperatury od stycznia do lutego przekraczają -1°C. Podobne warunki obserwuje się na południowo-zachodnim wybrzeżu Szwecji.
czynniki wpływające na występowanie
- Nietolerancja mrozu: Występowanie przybrzeżne może wynikać z nietolerancji gatunku na silne mrozy.
- Wschodnia granica zasięgu: Brak danych uniemożliwia dokładne określenie wschodniej granicy występowania gatunku.
pomyłki w identyfikacji
- Chromosera citrinopallida i Hygrocybe ceracea: Niektóre doniesienia o występowaniu G. vitellinus w śródlądowych, alpejskich lub kontynentalnych częściach Europy mogą wynikać z pomyłek z gatunkami Chromosera citrinopallida lub Hygrocybe ceracea.
- Potrzeba weryfikacji: Informacje z niektórych krajów i lokalizacji wymagają potwierdzenia za pomocą mikroskopii lub analizy DNA.
Populacja i trendy liczebności
Gloioxanthomyces vitellinus to gatunek grzyba, którego całkowita populacja prawdopodobnie przekracza 20 000 dojrzałych osobników. Jednak jego liczebność maleje we wszystkich znanych krajach występowania, głównie z powodu zaniku tradycyjnych praktyk rolniczych i zarządzania użytkami zielonymi, szczególnie na obszarach przybrzeżnych i nizinnych.
Dane z GBIF
- Baza danych GBIF (Global Biodiversity Information Facility) odnotowuje około 500 stanowisktego gatunku, ale liczba ta jest prawdopodobnie zawyżona z powodu pomyłek z innymi gatunkami.
Utrata siedlisk
- Spadek siedlisk: Szacuje się, że w ciągu ostatnich 75 lat w Europie Zachodniej utracono 90% siedlisk odpowiednich dla grzybów z grupy CHEG (skrót od Clavariaceae, Hygrocybe sensu lato, Entoloma i Geoglossaceae – grupa grzybów łąkowych).
- Spadek powierzchni trawiastych: Według Organizacji Narodów Zjednoczonych ds. Wyżywienia i Rolnictwa (FAO), powierzchnia terenów trawiastych w Unii Europejskiej zmniejszyła się o 12,8% w ciągu 13 lat (1990–2003).
Jakość siedlisk
- Degradacja siedlisk: Jakość półnaturalnych terenów trawiastych również ulega pogorszeniu, co dodatkowo przyspiesza spadek populacji.
- Stan ochrony: Ponad 75% siedlisk trawiastych w UE znajduje się w niekorzystnym stanie ochrony.
Siedlisko i ekologia
Gloioxanthomyces vitellinus to gatunek grzyba, który jest wskaźnikiem bogatych mykologicznie, ale ubogich w składniki odżywcze, półnaturalnych łąk. Występuje często na kwaśnych glebach, będąc częścią zespołu łąk woskowych. Te siedliska, choć ważne dla różnorodności biologicznej, szybko zanikają z powodu zmian w użytkowaniu gruntów.
charakterystyka siedlisk
- Półnaturalne łąki: W Norwegii większość stanowisk tego gatunku znajduje się na półnaturalnych łąkach lub trawiastych/mchowych obszarach na przybrzeżnych wrzosowiskach zdominowanych przez Calluna (wrzos).
- Inne siedliska: Gatunek ten odnotowano również na stałych wydmach, wilgotnych glebach w zaroślach wierzbowych (Salix) oraz raz na leśnym torfowisku.
związek z roślinami
- Biotrofia: Obecnie uważa się, że G. vitellinus tworzy biotroficzny związek z roślinami, choć szczegóły tego związku pozostają niejasne.
Cykl życia
- Owocniki: Owocniki tego gatunku są krótkotrwałe, żyją zaledwie kilka tygodni.
- Grzybnia: Podejrzewa się, że grzybnia jest długowieczna, mogąca przetrwać 50–100 lat.
sytuacja i zagrożenia
Gloioxanthomyces vitellinus to europejski gatunek grzyba, który występuje głównie na półnaturalnych terenach trawiastych, szczególnie na nizinach w pobliżu wybrzeży (gatunek o charakterze oceanicznym). Jego siedliska są silnie zagrożone z powodu zmian w praktykach rolniczych, rozwoju infrastruktury oraz zanieczyszczeń.
Spadek siedlisk i populacji
- Utrata siedlisk: Szacuje się, że w ciągu ostatnich 50 lat (około trzech pokoleń) nastąpiła utrata ponad 50% siedlisk tego gatunku.
- Pogorszenie jakości siedlisk: Jakość pozostałych siedlisk również uległa znacznemu pogorszeniu, co sugeruje, że rzeczywisty spadek liczebności populacji może być jeszcze większy.
- Przyszłość: Proces utraty i degradacji siedlisk nadal trwa i oczekuje się, że będzie postępował przez kolejne 50 lat. Spadek ten może być nawet większy niż średnia dla innych trawiastych siedlisk w Europie.
Występowanie i liczebność
- GBIF: Baza GBIF odnotowuje około 500 stanowisk tego gatunku.
- Liczebność: Zakłada się, że globalna populacja G. vitellinus liczy ponad 20 000 dojrzałych osobników.
- Globalny spadek: W skali europejskiej przyjmuje się, że populacja tego gatunku zmniejszyła się średnio o ponad 50% w ciągu ostatnich 50 lat, a trend ten prawdopodobnie utrzyma się w przyszłości.
Główne zagrożenia
- Zniszczenie siedlisk:
- Zarastanie półnaturalnych terenów trawiastych z powodu zaprzestania wypasu i koszenia.
- Intensyfikacja rolnictwa, w tym stosowanie nawozów, pestycydów i orka.
- Zmiana użytkowania gruntów na cele przemysłowe, mieszkaniowe lub infrastrukturalne.
- Zanieczyszczenia:
- Depozycja azotu z powietrza, która negatywnie wpływa na jakość siedlisk.
- Brak znaczenia gospodarczego:
- Półnaturalne tereny trawiaste mają niewielką wartość ekonomiczną we współczesnym rolnictwie, co prowadzi do ich dalszej degradacji i zaniku.
- Zniszczenie siedlisk:
Stan ochrony siedlisk
- Większość siedlisk trawiastych, w których występuje G. vitellinus, jest wymieniona na Czerwonej Liście siedlisk UE jako narażone (VU), zagrożone (EN) lub krytycznie zagrożone (CR).
- Ponad 75% trawiastych siedlisk w UE znajduje się w niekorzystnym stanie ochrony, co potwierdzają dane zgłoszone przez państwa członkowskie w ramach dyrektywy siedliskowej.
Podsumowanie
Gloioxanthomyces vitellinus to gatunek silnie zagrożony z powodu utraty i degradacji swoich siedlisk. Bez podjęcia pilnych działań ochronnych, takich jak przywracanie półnaturalnych terenów trawiastych i ograniczenie zanieczyszczeń, gatunek ten może nadal tracić swoje populacje w Europie.
Małże
Perłoródka rzeczna. Freshwater Pearl Mussel (Margaritifera margaritifera) Europejska Czerwona Lista. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Owady, grzyby, małże, ślimaki. Stan na 15 marca 2025 r
1. Perłoródka rzeczna. Freshwater Pearl Mussel
(Margaritifera margaritifera)
Perłoródka rzeczna Margaritifera margaritifera została ostatnio wpisana na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2010 r. Margaritifera margaritifera jest uznawana za gatunek zagrożony.
Cechy morfologiczne
Margaritifera margaritifera (perłoródka słodkowodna) charakteryzuje się masywną, grubościenną muszlą o charakterystycznym kształcie i budowie.
Kształt i powierzchnia muszli:
- Kształt: Muszla ma kształt nerkowaty. Krawędź grzbietowa jest wygięta, a brzuszna wklęsła. Przedni brzeg jest zaokrąglony, a tylny zaostrzony.
- Wierzchołki: Przesunięte ku przodowi, często silnie skorodowane. Część muszli położona za wierzchołkami jest trzykrotnie dłuższa niż część przednia.
- Powierzchnia zewnętrzna: Czarnej lub ciemnobrązowej barwy, z wyraźnymi, blisko położonymi liniami przyrostów.
Zamek muszli:
- Prawa połówka: Przedni ząb jest wysoki i wąski, podczas gdy ząb główny i tylny boczny są zredukowane.
- Lewa połówka: Ząb główny jest spłaszczony i karbowany, a ząb boczny przedni – wąski, ostry i karbowany, oddzielony głęboką szczeliną.
- Ligamentum: Krótkie, masywne i wystające.
Wnętrze muszli:
- Powierzchnia wewnętrzna: Charakteryzuje się silnym perłowym połyskiem.
- Odcisk mięśni:
- Mięsień zwieracz przedni: Nerkowaty.
- Mięsień zwieracz tylny: Owlowaty.
- Mięśnie wciągacze nogi: Prawie półksiężycowate.
Wymiary muszli:
- Długość: 100–160 mm.
- Szerokość: 30–40 mm.
- Wysokość: 45–60 mm.
zasięg geograficzny
Choć w całym swoim zasięgu szacuje się, że istnieje około 200 milionów dojrzałych osobników, degradacja siedlisk powoduje, że liczba nowych rekrutacji jest bardzo ograniczona. Większość subpopulacji jest silnie rozdrobniona i izolowana, a naturalna wymiana genetyczna między nimi jest znikoma. W efekcie, gdy dorosłe osobniki obumierają, nie są one zastępowane, co skutkuje powszechnym wymieraniem funkcjonalnym w większości zasięgu.
W Europie obecny obszar występowania (AOO) wynosi około 56 km² (52 km² w krajach UE-28), mimo że zasięg występowania (EOO) szacuje się na kilkaset tysięcy km². Poszczególne kraje wykazują bardzo zróżnicowane dane:
- Austria: Obecnie 29 subpopulacji, 50 000 osobników, z wyraźnym spadkiem – tylko kilka subpopulacji wykazuje ograniczoną rekrutację.
- Belgia: 5–6 subpopulacji liczących 2 500–3 000 osobników, gdzie wszystkie subpopulacje praktycznie przestały się rekrutować.
- Czechy: Sześć subpopulacji, 80 000 osobników; jedna duża subpopulacja o liczbie około 60 000 osobników, pozostałe znacznie mniejsze.
- Dania: Maksymalnie jedna subpopulacja, ostatni zapis datowany jest na lata 70., co sugeruje jej wymarcie.
- Estonia: Jedna subpopulacja z 35 000–40 000 osobników, bez rekrutacji przez co najmniej 40 lat.
- Finlandia: Około 50 subpopulacji, 1,5 miliona osobników; znaczna utrata rekrutujących subpopulacji w XX wieku, pozostaje tylko kilka funkcjonalnych.
- Francja: Maksymalnie 84 subpopulacje, około 100 000 osobników; większość subpopulacji to niewielkie grupy, jedynie jedna subpopulacja osiąga 16 000 osobników, lecz z ograniczoną rekrutacją.
- Niemcy: 69 subpopulacji, 144 000 osobników, z drastycznym spadkiem liczby rekrutujących subpopulacji.
- Wielka Brytania: Około 105 subpopulacji, ponad 12 milionów osobników; prognozy wskazują na spadek do około 10 subpopulacji i 1 miliona osobników.
- Republika Irlandii: 139 subpopulacji, 12 milionów osobników, które mogą się zmniejszyć do zaledwie sześciu subpopulacji i 600 tysięcy osobników.
- Łotwa: Osiem subpopulacji z 25 000 osobników, przy całkowitym braku rekrutacji.
- Litwa: Prawdopodobnie jedna subpopulacja o nieokreślonej liczbie osobników.
- Luksemburg: Jedna subpopulacja licząca 1 000–1 500 osobników, z prognozowanym całkowitym zanikiem.
- Norwegia: Około 340–350 subpopulacji, szacunkowo 300 milionów osobników, przy umiarkowanej utracie rekrutujących subpopulacji.
- Polska: Gatunek uznawany za wymarły, brak obecnych subpopulacji.
- Portugalia: Sześć subpopulacji, ponad 1 milion osobników; w trzech dużych subpopulacjach występuje rekrutacja, lecz prognozuje się dalsze spadki.
- Rosja: Ponad osiem subpopulacji, przekraczających 100 milionów osobników, lecz z ostrą tendencją do redukcji do około trzech subpopulacji i 30 milionów osobników.
- Hiszpania: 19 subpopulacji, z przewidywanym znacznym spadkiem rekrutujących subpopulacji.
- Szwecja: Ponad 400 subpopulacji, 8 milionów osobników, z prognozowanym spadkiem do około 50 subpopulacji i 1 miliona osobników.
Ogólne szacunki wskazują, że w Europie w 1920 roku było około 2 613 subpopulacji z 2 miliardami osobników, a w 2010 roku spadło to do 1 282 subpopulacji i 423 milionów osobników. Prognozy na rok 2100 są jeszcze bardziej alarmujące – przewiduje się redukcję do około 204 subpopulacji i 47 milionów osobników.
Podsumowując, mimo pozornej liczebności, brak efektywnej rekrutacji oraz rozdrobnienie subpopulacji powodują, że małż perłowy jest zagrożony funkcjonalnym wyginięciem. Utrata rekrutujących subpopulacji w ciągu ostatnich trzech pokoleń jest drastyczna, co stanowi krytyczny problem dla długoterminowego przetrwania gatunku. Skuteczna ochrona tego gatunku wymaga kompleksowego zarządzania zlewniami oraz działań na rzecz przywrócenia odpowiednich warunków siedliskowych.
populacja
Margaritifera margaritifera wykazuje paradoksalny status ochronny. Pomimo, że w całym swoim zasięgu występuje około 200 milionów dojrzałych osobników, poważna degradacja siedlisk doprowadziła do bardzo ograniczonej rekrutacji. W rezultacie wiele subpopulacji pozostaje izolowanych, z minimalnym przepływem genetycznym, a po śmierci dorosłych osobników nie następuje ich zastąpienie. W efekcie funkcjonalne wyginięcie jest powszechne na całym obszarze występowania.
Zrewidowane szacunki, oparte na okresie 90 lat (trzy pokolenia), wskazują na ogólny spadek populacji o około 81,5% w Europie – przy 87% utracie w krajach UE – podczas gdy globalny spadek wynosi około 61,5%. Ten spadek odzwierciedla się w dramatycznych redukcjach zarówno obszaru zajmowanego (AOO), jak i liczby funkcjonalnych subpopulacji.
Oceny specyficzne dla poszczególnych krajów wskazują, że:
- W Austrii obecne szacunki wskazują na 29 subpopulacji liczących około 50 000 osobników, w porównaniu do szacowanych 5 milionów w przeszłości, przy czym prognozy przewidują spadek do zaledwie 1 000 osobników.
- W Belgii występuje obecnie 5–6 subpopulacji (około 2 500–3 000 osobników), a prognozy na przyszłość wskazują na całkowitą utratę.
- W Czechach odnotowuje się sześć subpopulacji liczących około 80 000 osobników, jednak przyszłe szacunki przewidują upadek do jednej subpopulacji z około 1 000 osobników.
- W Danii, Estonii, Luksemburgu oraz w niektórych regionach Litwy przewiduje się całkowitą utratę subpopulacji rekrutujących.
- W Finlandii i Francji oczekuje się poważnych strat, z utratą subpopulacji rekrutujących na poziomie 78–96%.
- W Niemczech obserwuje się redukcję z ponad 100 subpopulacji w przeszłości do potencjalnie jednej w przyszłości.
- W Wielkiej Brytanii, mimo że obecnie występuje około 105 subpopulacji (około 12 milionów osobników), prognozy na przyszłość sugerują redukcję do około 10 subpopulacji i 1 miliona osobników.
- W Republice Irlandii sytuacja jest dramatyczna – obecnie 139 subpopulacji (około 12 milionów osobników) ma spaść do zaledwie sześciu subpopulacji, liczących 600 000 osobników.
- Norwegia wykazuje nieco mniej dramatyczną utratę (około 60%), natomiast w Portugalii i Rosji przyszłe prognozy wskazują na utratę subpopulacji rekrutujących odpowiednio o 50% i 90%.
- W Hiszpanii przewiduje się redukcję z 19 subpopulacji do zaledwie 2, a w Szwecji liczba subpopulacji może spaść z 400 (8 milionów osobników) do około 50 subpopulacji (około 1 miliona osobników).
Ogólnie, szacunki europejskie na rok 2010 wynosiły około 1 282 subpopulacji z 423 milionami osobników, w porównaniu z około 2 613 subpopulacjami i 2 miliardami osobników w roku 1920. Prognozy na rok 2100 są jeszcze bardziej alarmujące – przewiduje się redukcję do zaledwie 204 subpopulacji i 47 milionów osobników.
Ten dramatyczny spadek podkreśla, że mimo pozornie dużej liczby osobników, utrata funkcjonalnych populacji – spowodowana izolacją, degradacją siedlisk oraz brakiem rekrutacji nowych osobników – stanowi krytyczne zagrożenie dla długoterminowego przetrwania gatunku. Skuteczna ochrona wymaga nie tylko zabezpieczenia istniejących siedlisk, ale także przywrócenia warunków umożliwiających efektywną rekrutację kolejnych pokoleń.
Siedlisko i ekologia
Zrównoważone populacje małży perłowej (Margaritifera) ograniczone są do prawie naturalnych, czystych wód płynących – najczęściej poniżej ultraoligotroficznych jezior – oraz rzek, gdzie woda swobodnie wymienia się z podłożem.
Gatunek ten wymaga stabilnych podłoży, składających się z otoczaków i żwiru, z minimalną ilością drobnego materiału, który mógłby utrudniać przepływ tlenu. Kluczowym warunkiem jest, aby podłoże było pozbawione nieorganicznego mułu, organicznego torfu i detrytusu, które mogą blokować wymianę tlenu, a także obecności glonów nitkowatych i zakorzenionych makrofitów, które ograniczają przepływ wody między otwartą przestrzenią a osadem.
Swobodna wymiana wody umożliwia utrzymanie wysokiego poziomu tlenu w podłożu – niezbędnego do rekrutacji młodych małży, które przez pierwsze 5–10 lat życia są całkowicie zakopane. Rozpuszczone składniki odżywcze w toni wodnej muszą być utrzymywane na ultraoligotroficznych poziomach, aby zapobiec nadmiernemu wzrostowi glonów, co mogłoby prowadzić do nocnych spadków tlenu na granicy woda-osad.
Dodatkowo, obecność odpowiedniej liczby ryb łososiowatych, które przenoszą larwalne stadium glochidialne, jest niezbędna dla kontynuacji cyklu życia małży perłopławnych. Najlepsze populacje odnotowuje się w odizolowanych, mało intensywnie zarządzanych zlewniach, gdzie naturalne procesy chronią siedlisko młodych osobników.
Niestabilność zlewni rzek, prowadząca do chronicznego zamulenia podłoża i gromadzenia się składników odżywczych, może powodować przekształcenie warunków oligotroficznych w eutroficzne, co dodatkowo stresuje zarówno młode, jak i dorosłe małże. W takich warunkach rekrutacja nowych pokoleń jest zaburzona, mimo że starsze osobniki mogą przetrwać przez wiele lat, filtrując otwartą wodę.
Podsumowując, przetrwanie małży perłowych zależy od utrzymania bardzo czystych, dobrze natlenionych siedlisk rzecznych, w których zachowana jest naturalna wymiana wody między otwartym strumieniem a osadem. Skuteczne zarządzanie zlewniami rzek jest kluczowe dla ochrony tych gatunków.
zagrożenia.
Margaritifera margaritifera (perłoródka słodkowodna) to gatunek małża słodkowodnego, który od dziesięcioleci doświadcza drastycznego spadku liczebności. Gatunek ten jest silnie uzależniony od czystych, dobrze natlenionych wód rzecznych, ale jego populacje są zagrożone przez szereg czynników, w tym zanieczyszczenie wody, zmiany siedliskowe i presję ze strony działalności człowieka.
Główne przyczyny spadku populacji
- Zamulenie i zanieczyszczenie osadami:
- Gromadzenie się drobnego osadu w żwirach koryta rzeki jest głównym czynnikiem ograniczającym rekrutację młodych osobników. Osad blokuje dopływ tlenu do podłoża, uniemożliwiając rozwój młodocianych małży.
- Drobny osad może również bezpośrednio zabijać dorosłe osobniki, powodując ich zamknięcie się i śmierć z powodu niedoboru tlenu.
- Źródłem osadów są praktyki rolnicze, erozja brzegów rzek, wycinka lasów i działalność górnicza.
- Zanieczyszczenie składnikami odżywczymi:
- Wprowadzenie nawozów i ścieków do rzek prowadzi do eutrofizacji, co sprzyja wzrostowi glonów nitkowatych i makrofitów. Te organizmy blokują wymianę tlenu między wodą a podłożem, co jest szczególnie szkodliwe dla młodych małży.
- Rozkład glonów i makrofitów uwalnia dodatkowe składniki odżywcze, pogłębiając problem eutrofizacji.
- Zmiany hydrologiczne:
- Regulacja rzek, budowa tam i kanałów oraz osuszanie terenów zalewowych zmieniają naturalne wzorce przepływu wody, co prowadzi do destabilizacji siedlisk małży.
- Sztuczne zmiany przepływu mogą powodować stres u dorosłych osobników i utrudniać rozmnażanie.
- Zanik ryb żywicielskich:
- Larwy małży (glochidia) pasożytują na rybach słodkowodnych, takich jak Salmo salar (łosoś) i Salmo trutta (pstrąg). Spadek liczebności tych ryb ogranicza możliwość rekrutacji nowych pokoleń małży.
- Przeszkody w migracji ryb, takie jak tamy, dodatkowo pogarszają sytuację.
- Działalność rolnicza i leśna:
- Intensyfikacja rolnictwa, w tym stosowanie nawozów, pestycydów i wapnowanie gleb, prowadzi do zanieczyszczenia wód i zwiększenia ilości osadów.
- Wycinka lasów i zarządzanie plantacjami drzew iglastych przyczyniają się do erozji gleby i zakwaszenia wód.
- Inwazyjne gatunki:
- Wprowadzenie obcych gatunków roślin, takich jak Ranunculus, może zmieniać strukturę siedlisk, utrudniając rozwój małży.
- Zmiana klimatu:
- Wzrost temperatur może przyspieszyć metabolizm małży, skracając ich życie i zmniejszając liczbę cykli reprodukcyjnych.
- Częstsze susze i powodzie mogą destabilizować siedliska, zwiększając ryzyko zamulenia i utraty tlenu.
- Zamulenie i zanieczyszczenie osadami:
Skutki długoterminowe
- Nierekrutujące subpopulacje: Wiele populacji małży składa się wyłącznie z dorosłych osobników, które nie są w stanie produkować nowych pokoleń z powodu degradacji siedlisk.
- Spadek liczebności: Szacuje się, że w ciągu ostatnich 90 lat globalna populacja Margaritifera margaritifera zmniejszyła się o 61,5%.
- Wymieranie lokalne: W niektórych krajach, takich jak Holandia, gatunek ten już wyginął, a w innych, takich jak Irlandia, jego populacje zmniejszyły się o ponad 50%.
działania ochronne
Aby ratować Margaritifera margaritifera, konieczne są pilne działania, w tym:
- Ochrona i renaturyzacja siedlisk: Przywracanie naturalnych ekosystemów rzecznych, w tym usuwanie tam i przywracanie naturalnych przepływów.
- Kontrola zanieczyszczeń: Ograniczenie spływu nawozów, pestycydów i osadów do rzek.
- Programy hodowli konserwatorskiej: Hodowla małży w kontrolowanych warunkach i reintrodukcja ich do naturalnych siedlisk.
- Edukacja i świadomość: Podnoszenie świadomości na temat znaczenia ochrony tego gatunku i jego siedlisk.
Podsumowanie
Margaritifera margaritifera to gatunek w kryzysie, którego przyszłość zależy od skutecznej ochrony siedlisk i poprawy warunków wodnych. Bez pilnych działań ochroniarskich, takich jak renaturyzacja rzek i kontrola zanieczyszczeń, gatunek ten może zniknąć na zawsze.sze.

2. Skójka gruboskorupowa. Thick Shelled River Mussel. (Unio crassus)
Gruboskorupowa skójka rzeczna Unio crassus została ostatnio oceniona pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2022 r. Gatunek ten znajduje się na liście gatunków zagrożonych.
Opis muszli
Unio crassus (skójka gruboskorupowa) charakteryzuje się masywną, grubościenną muszlą o jajowatoprostokątnym zarysie. Wierzchołki muszli są słabo wystające, przesunięte ku przodowi, a część przednia jest 3–4 razy krótsza niż tylna. Wierzchołki często ulegają silnej erozji.
- Kształt i powierzchnia muszli:
- Krawędź grzbietowa jest silnie wygięta, a brzuszna lekko wygięta.
- Przedni brzeg jest łukowato zaokrąglony, a tylny tępo klinowaty.
- Powierzchnia zewnętrzna jest gładka, z delikatnie zaznaczonymi liniami przyrostów.
- Muszle wykazują duże zróżnicowanie kształtów i kolorów – przeważają ciemne barwy, od rogowych po ciemnobrunatne, a z wiekiem ciemnieją do czarnego.
- Zamek muszli:
- W prawej połówce brak zęba głównego, obecny jest tylko ząb przedni boczny.
- W lewej połówce ząb boczny wewnętrzny jest szeroki i niski, ząb centralny wysoki i stożkowaty, a zęby tylne boczne wąskie i długie.
- Wnętrze muszli:
- Wewnętrzna powierzchnia jest gładka, z perłowym połyskiem.
- Odcisk mięśnia zwieracza przedniego ma kształt owalny, a mięśnia wyciągacza nogi – wąski i półokrągły.
- Kształt i powierzchnia muszli:
Wymiary muszli:
- Długość: 40–72 mm
- Szerokość: 19–28 mm
- Wysokość: 25–45 mm
Zmienność fenotypowa
Unio crassus wykazuje dużą zmienność fenotypową, obejmującą kształt, grubość i barwę muszli. W przeszłości wyróżniano wiele form i podgatunków, np. na terenie Polski opisano U. c. polonicus, U. c. ornatus i U. c. oviformis. Jednak obecnie uważa się, że są to przejawy plastyczności fenotypowej, a nie odrębne podgatunki.
zasięg geograficzny
Unio crassus to gatunek endemiczny dla Europy, występujący głównie w dorzeczach Atlantyku i Bałtyku, od Francji po Rosję, w tym w Szwecji i Finlandii. Jego zasięg obejmuje również dorzecza Europy Wschodniej uchodzące do Morza Czarnego i Kaspijskiego, od Dunaju po Ural (Lopes-Lima i in. 2024).
Rewizja taksonomiczna
Wcześniej Unio crassus był uważany za gatunek o szerokim zasięgu, obejmujący liczne podgatunki. Haas (1969) wyróżnił osiem ras/podgatunków, które później uznano za część kompleksu U. crassus (np. Graf i Cummings 2007). Jednak współczesne badania molekularne i taksonomiczne znacząco zmieniły klasyfikację tego gatunku:
- Populacje iberyjskie (dawniej U. crassus batavus) zostały przeniesione do gatunku Unio tumidiformis (Reis i Araujo 2009).
- Populacje azjatyckie (dawniej U. crassus mongolicus) zostały zaklasyfikowane jako Middendorffinaia mongolica (Lopes-Lima i in. 2020).
- Populacje z Turcji, Grecji i Bałkanów (dawniej U. crassus bruguierianus, U. crassus carneus i U. crassus ionicus) zostały podzielone na pięć odrębnych gatunków: U. bruguierianus, U. vicarius, U. ionicus, U. desectus i U. carneus ,
- Populacje z Gruzji, Armenii i górnego Eufratu (dawniej U. crassus gontieri) zostały uznane za odrębny gatunek – Unio gontieri (Lopes-Lima i in. 2024).
- Populacje z zachodniej i środkowej Europy (dawniej U. crassus cytherea) zostały przeniesione do gatunku Unio nanus, który występuje sympatrycznie z U. crassus w basenach rzecznych od Sekwany na zachodzie po Wisłę na wschodzie.
Podsumowanie
Rewizja taksonomiczna Unio crassus znacząco zawęziła jego zasięg i wykazała, że wiele populacji, wcześniej uznawanych za podgatunki, należy do odrębnych gatunków. Obecnie U. crassus sensu stricto występuje głównie w Europie Środkowej i Wschodniej, podczas gdy inne populacje zostały sklasyfikowane jako odrębne gatunki, co podkreśla bogactwo różnorodności biologicznej w obrębie tej grupy małży.
populacja
Unio crassus, czyli skójka gruboskorupowa, jest obecnie uważany za gatunek wysoce zagrożony na poziomie Unii Europejskiej oraz w wielu krajach europejskich. Jego populacje dramatycznie maleją, a liczba subpopulacji znacznie spadła w całym zasięgu występowania (Lopes-Lima i in. 2017).
Drastyczny spadek populacji
Spadek liczebności Unio crassus rozpoczął się w latach 70. XX wieku w najbardziej uprzemysłowionych regionach Europy Zachodniej, gdzie intensywny rozwój rolnictwa i przemysłu doprowadził do zniszczenia siedlisk i zanieczyszczenia wód. W latach 1980–2022 druga fala spadku dotknęła kraje Europy Wschodniej, gdzie modernizacja i intensyfikacja agroprzemysłu znacząco pogorszyły warunki środowiskowe.
Przykłady spadku populacji w Europie
- Holandia: gatunek wymarł (Nienhuis 2012).
- Finlandia: populacja zmniejszyła się o co najmniej 30% w ciągu ostatnich trzech pokoleń (Hyvärinen i in. 2019).
- Francja: zasięg występowania (EOO) zmniejszył się o 42% (Prié i in. 2014).
- Niemcy: liczba subpopulacji spadła o ponad 65% w niektórych regionach (Zettler i Jueg 2007; Binot-Hafke i in. 2011).
- Polska: w latach 90. XX wieku liczba subpopulacji zmniejszyła się o ponad 60% (Piechocki i Dyduch-Falniowska 1993).
- Szwecja: populacja nadal spada, choć w niektórych rejonach pozostaje stabilna (M. Osterling, dane osobiste).
- Ukraina: liczba subpopulacji zmniejszyła się o ponad 50% (dane własne L. Szewczuka).
Podsumowanie
Szacuje się, że w ciągu ostatnich 60 lat (1962–2022) populacja Unio crassus zmniejszyła się o ponad 50% w całej Europie. Zagrożenia dla tego gatunku – takie jak zanieczyszczenie wody, niszczenie siedlisk, inwazyjne gatunki i zmiany klimatyczne – nadal rosną, co stawia Unio crassus na skraju wyginięcia.
Sytuacja w Polsce
W Polsce Unio crassus występuje głównie w czystych, płynących wodach, szczególnie w mniejszych rzekach i strumieniach. Niestety, jego populacje są coraz bardziej izolowane, a wiele z nich zanika z powodu degradacji środowiska. Szacuje się, że w ciągu ostatnich 60 lat liczebność tego gatunku w Polsce spadła o ponad 50%.
Siedlisko i ekologia
Unio crassus (skójka gruboskorupowa) to gatunek małża słodkowodnego, który zamieszkuje czyste ekosystemy rzeczne z płynącą wodą i różnorodnym podłożem, takim jak piasek, żwir i drobny osad denny. Preferuje brzegi rzek, zwłaszcza w pobliżu przeszkód w korycie, takich jak korzenie czy głazy, ale może występować również w środkowych lub głębszych częściach koryta, jeśli osad jest stabilny.
Gatunek ten jest wrażliwy na zmiany chemii wody, szczególnie na wysokie stężenia azotanów i fosforanów, a także na degradację naturalnych systemów rzecznych.
Biologia i rozmnażanie
Unio crassus ma typowe cechy reprodukcyjne dla rodziny Unionidae, w tym opiekę rodzicielską nad larwami (glochidia) i pasożytnictwo larw na rybach słodkowodnych. Larwy pasożytują na różnych gatunkach ryb, takich jak Phoxinus phoxinus, Cottus gobio, Squalius cephalus i innych. Skuteczność pasożytowania zależy od gatunku ryby i obszaru geograficznego.
Samice składają jaja na torbaczach, a okres inkubacji trwa od 10 do 30 dni, w zależności od pory roku. W Polsce samice mogą składać od 3 do 7 lęgów rocznie, a tarło trwa od wczesnej wiosny do początku sierpnia.
Długość życia i wzrost
Długość życia Unio crassus jest zmienna i zależy od warunków klimatycznych, hydrologicznych i szerokości geograficznej. Zwykle wynosi od 20 do 30 lat, choć może się wahać od 8 do nawet 90 lat. Maksymalna długość muszli zwykle nie przekracza 8 cm, ale w zależności od warunków może wynosić od 5 do 11 cm.
Zimowanie i śmiertelność
Gatunek ten zimuje w osadach dennych, przykryty liśćmi i gruzem, zwykle w pobliżu dna koryta. Naturalna śmiertelność jest najwyższa wiosną, a minimalna w późniejszych miesiącach roku.
Podsumowanie
Unio crassus to gatunek o złożonej biologii, ściśle zależny od czystych, płynących wód i obecności odpowiednich gatunków ryb żywicielskich. Jego wrażliwość na zmiany środowiskowe sprawia, że jest szczególnie narażony na wyginięcie, co podkreśla potrzebę skutecznej ochrony jego siedlisk.
zagrożenia
Unio crassus – europejski gatunek endemiczny – jest klasyfikowany jako Zagrożony (A2ac) na Czerwonej Liście IUCN. Gatunek ten doświadczył drastycznego spadku liczebności, szacowanego na ponad 50% w ciągu ostatnich 60 lat, z powodu licznych zagrożeń, w tym:
- Zniszczenia siedlisk: regulacja rzek, budowa tam i drenaż.
- Zanieczyszczenia wody: chemikalia i nawozy wpływające na jakość wody.
- Sedymentacji: zamulanie wód, które niszczy naturalne środowisko życia.
- Zwiększonego drapieżnictwa: presja ze strony inwazyjnych gatunków.
Unio crassus jest szczególnie wrażliwy na zmiany w chemii wody. Młode osobniki są podatne na zmiany jakości wody, a rozmnażanie dorosłych jest blokowane przy stężeniach azotanów powyżej 10 mg/l . Gatunek ten toleruje umiarkowaną eutrofizację w naturalnie czystych rzekach, ale wymaga stabilnych warunków środowiskowych do przetrwania.
Drapieżnictwo to kolejne poważne zagrożenie. Choć naturalnym drapieżnikiem Unio crassus była wydra europejska (Lutra lutra), wprowadzenie inwazyjnych gatunków, takich jak piżmak, nutria, szop i norka amerykańska, znacząco zwiększyło presję drapieżników.
Dodatkowo, spadek liczebności gatunków żywicielskich, spowodowany degradacją siedlisk i drapieżnictwem, negatywnie wpłynął na skuteczność rekrutacji nowych osobników.
Niestety, zagrożenia dla Unio crassus nadal rosną, a bez podjęcia pilnych działań ochronnych, gatunek ten może zniknąć na zawsze. Kluczowe jest przywracanie naturalnych siedlisk, kontrola zanieczyszczeń wody oraz zarządzanie inwazyjnymi gatunkami, aby zapewnić przetrwanie tego cennego gatunku.
Szczeżuja spłaszczona. Depressed River Mussel (Pseudanodonta complanata) Europejska Czerwona Lista. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Owady, grzyby, małże, ślimaki. Stan na 15 marca 2025 r
3. Szczeżuja spłaszczona. Depressed River Mussel
(Pseudanodonta complanata)
Skójka rzeczna Pseudanodonta complanata została ostatnio oceniona pod kątem wpisania na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody (IUCN) w 2022 r. Pseudanodonta complanata jest wymieniona jako gatunek zagrożony
zasięg geograficzny
Pseudanodonta complanata to gatunek szeroko rozpowszechniony w północnej Europie, od Wielkiej Brytanii na zachodzie po Rosję na wschodzie (na zachód od Uralu), a na południu sięga do północnych Bałkanów (Chorwacja).
Mimo szerokiego zasięgu, populacje są zwykle nieliczne, niestabilne i rozproszone. Gatunek ten nie występuje na Półwyspie Iberyjskim, Włoskim ani na południowych Bałkanach. Jest uważany za endemit regionu paneuropejskiego. Wcześniejsze doniesienia o występowaniu w azjatyckiej części Rosji i byłego Związku Radzieckiego (np. Kazachstan) są błędne.
występowanie w poszczególnych krajach
- Austria: Dawniej występował w Dunaju i jego dopływach, ale obecnie jest niezwykle rzadki i uznany za krytycznie zagrożony.
- Białoruś: Odnotowany w jeziorach Lepelskoe, Narocz, Dolzha i Malye Shvaksht w północno-zachodniej części kraju (basen bałtycki).
- Anglia: Kiedyś szeroko rozpowszechniony, obecnie bardzo rzadki. Zniknął z niektórych wcześniejszych stanowisk, np. z rzeki Tamizy i rzeki Great Stour, prawdopodobnie z powodu zmian w praktykach rolniczych.
- Czechy: Występuje w kilku rozproszonych subpopulacjach.
- Francja: Dawniej szeroko rozpowszechniony, obecnie wymarły lub rzadki w dużych częściach kraju, takich jak Garonna, Saône-Rhône i Doubs. Uznany za zagrożony ze względu na ograniczony zasięg i spadek liczebności.
- Węgry: Występuje w rzekach Cisa, Mura, Drawa i Dunaj.
- Norwegia: Występuje wyłącznie w południowo-wschodniej części kraju.
- Polska: Występuje w większości kraju, z wyjątkiem terenów górskich, ale w niewielkiej liczebności.
- Rumunia: Odnotowany w rzekach Mures, Prut i Dunaj.
- Federacja Rosyjska: Występuje w zlewniach Morza Bałtyckiego, Czarnego, Azowskiego i Kaspijskiego. Najczęściej spotykany na północnym zachodzie (np. jezioro Pejpus, Pikhva, Ilmen) oraz na południowym zachodzie (basen Don, delta Wołgi). Jego obecność dalej na wschód (np. rzeka Ural) nie została potwierdzona.
- Słowacja: Występuje w dobrym stanie w rzekach Ipoly, Ondava i Dunaj.
- Szwecja: Występuje głównie w południowo-środkowej części kraju, z rzadkimi stanowiskami na północy.
- Ukraina: Występuje w całym kraju, z wyjątkiem Krymu.
populacja
Pseudanodonta complanata to gatunek, który zazwyczaj nie występuje w dużych zagęszczeniach i jest często uważany za rzadki. Mimo szerokiego zasięgu, jego populacje są nierównomiernie rozmieszczone i podatne na spadek liczebności.
Głównymi przyczynami są utrata siedlisk, degradacja środowiska oraz zanieczyszczenia. Szacuje się, że liczba subpopulacji zmniejszyła się o 50% w wielu krajach. Podczas gdy populacje w Europie środkowej, zachodniej i południowo-wschodniej znacznie maleją, te w basenie Morza Bałtyckiego wydają się bardziej stabilne.
sytuacja w poszczególnych krajach
- Białoruś: Sytuacja jest dość stabilna, odkryto kilka nowych subpopulacji.
- Francja: Gatunek poważnie zanika, z szacowanym spadkiem o 60%. Jest wymieniony jako zagrożony. Subpopulacja w basenie Garonny została utracona, a obecnie gatunek występuje głównie w północno-wschodniej części kraju, z izolowanymi populacjami w rzekach Rodan, Charente i Benaize oraz w Bretanii.
- Holandia: Populacja zmniejszyła się o ponad 50% od 1990 roku, znikając z północy i południowego wschodu kraju. Jednak w regionie delty Renu i Mozy obserwuje się odbudowę populacji po wcześniejszym wytępieniu przez zanieczyszczenia w latach 60. i 70. XX wieku.
- Niemcy: Populacje zostały wytępione w wielu regionach.
- Norwegia: Gatunek nie jest regularnie monitorowany, ale jest uważany za gatunek najmniejszej troski. Ostatnie badania ujawniły kilka nowych populacji.
- Polska: Sytuacja jest zróżnicowana. W niektórych zlewniach populacje wydają się stabilne, podczas gdy w innych ulegają wahaniom. Ogólnie jednak populacje są małe, odizolowane i w zaniku.
- Szwecja: Gatunek jest wymieniony jako bliski zagrożenia, choć ostatnie badania wykazały nowe populacje.
- Ukraina: Gatunek jest rzadki, z maksymalnym zagęszczeniem wynoszącym 4 osobniki/m² w rzece Dniepr. W porównaniu z poprzednimi badaniami, obecnie występuje na mniejszej liczbie stanowisk, co sugeruje spadek liczebności o ponad 50% w ciągu ostatnich 60 lat.
- Wielka Brytania: Gatunek zniknął z co najmniej 50% wcześniejszych stanowisk w ciągu ostatnich 20 lat.
Siedlisko i ekologia
Pseudanodonta complanata to gatunek małża słodkowodnego, który występuje głównie w rzekach, a także w niektórych jeziorach. Preferuje podłoża mulisto-piaszczyste. W Wielkiej Brytanii gatunek ten nie występuje w jeziorach, ale w Norwegii można go spotkać w niektórych zbiornikach jeziornych.
Zachowanie i adaptacje
- Kopanie nor: Gatunek ten kopie nory bardziej niż inne podobne gatunki, co pozwala mu na lepsze zakotwiczenie w podłożu.
- Rozmnażanie: P. complanata ma typowe cechy rozrodcze dla rodziny Unionidae, w tym opiekę rodzicielską nad larwami (glochidia) i pasożytnictwo larw na rybach słodkowodnych. Larwy zostały znalezione na różnych rodzimych gatunkach ryb, ale ich sukces metamorficzny nie został dokładnie zbadany.
Cykl życia
- Długość życia: Waha się od 8 do 32 lat, w zależności od szerokości geograficznej. W Wielkiej Brytanii maksymalny wiek jest zbliżony do dolnej granicy tego zakresu.
- Rozmiar: Osiąga maksymalną długość od 7 do 11 cm, ale zwykle około 9 cm.
- Dojrzałość płciowa: Osiągana w wieku około 3 lat.
- Rozmnażanie: Gatunek jest zwykle dwupienny (osobniki męskie i żeńskie występują oddzielnie). Larwy zimują w skrzelach ryb i są uwalniane wczesnym latem.
zagrożenia
sytuacja i zagrożenia
Pseudanodonta complanata to gatunek małża słodkowodnego, który jest zagrożony z powodu spadku liczebności i fragmentacji populacji. Szacuje się, że w ciągu ostatnich trzech pokoleń (około 45 lat) liczebność tego gatunku zmniejszyła się o co najmniej 50% w większości jego zasięgu.
główne zagrożenia
- Degradacja i utrata siedlisk:
- Złe zarządzanie rzekami, kanałowanie ( proces sztucznego przekształcania naturalnych cieków wodnych (rzek, strumieni) w kanały o regularnym kształcie, często prostoliniowe, w celu kontroli przepływu wody) i pobór wody.
- Zanieczyszczenie wody (organiczne i nieorganiczne) oraz zamulenie.
- Budowa tam i innych barier fizycznych, które fragmentują populacje.
2. Kłusownictwo:
- Małże są zbierane do prywatnych kolekcji i akwariów.
3, Gatunki inwazyjne:
- Corbicula fluminea, Sinanodonta woodiana oraz małże z rodziny Dreissenidae konkurują z P. complanata o zasoby.
- Piżmaki (Ondatra zibethicus) polują na ten gatunek we Francji i Luksemburgu.
4. Zjawiska klimatyczne:
- Susze i powodzie, które są coraz częstsze z powodu zmian klimatycznych, stanowią poważne zagrożenie.
5. Wypadki środowiskowe:
- Na przykład w Polsce wypadek łodzi w jeziorze spowodował uwolnienie dużych ilości fosforanów i toksyn, co doprowadziło do śmierci 83% osobników P. complanata w tym obszarze.
przyszłość gatunku
- Prognozy: Przewiduje się, że wraz z nasileniem się ekstremalnych zjawisk klimatycznych oraz rozprzestrzenianiem się gatunków inwazyjnych, P. complanata stanie się jeszcze bardziej zagrożony w najbliższej przyszłości.
Działania ochronne
Pseudanodonta complanata jest gatunkiem zagrożonym lub bliskim zagrożenia w wielu krajach w całym swoim zasięgu. W związku z tym podejmowane są różne działania ochronne, a gatunek jest objęty ochroną prawną w wielu regionach.
Status ochrony w poszczególnych krajach
- Austria: Krytycznie zagrożony (Czerwona Księga mięczaków).
- Białoruś: Zagrożony (Czerwona Księga Republiki Białorusi).
- Czechy: Zagrożony (Czeska Czerwona Lista bezkręgowców).
- Francja: Zagrożony (Francuska Czerwona Księga Gatunków).
- Niemcy: Krytycznie zagrożony (Niemiecka Czerwona Lista gatunków).
- Polska: Zagrożony (Polska Czerwona Księga bezkręgowców).
- Rumunia: Zagrożony.
- Słowacja: Zagrożony (Czerwona Księga mięczaków Słowacji).
- Szwecja: Bliski zagrożenia (Czerwona Księga Gatunków Szwedzkich).
- Węgry: Zagrożony (chroniony przez krajowe ustawodawstwo).
- Wielka Brytania: Bliski zagrożenia (Brytyjska Czerwona Lista).
Potrzebne działania ochronne
- Ochrona siedlisk:
- Utworzenie obszarów chronionych obejmujących główne siedliska gatunku, takie jak jeziora, rzeki i strumienie.
- Odbudowa siedlisk, w tym renaturyzacja całych dorzeczy.
- Kontrola zanieczyszczeń:
- Identyfikacja i eliminacja źródeł zanieczyszczeń, zarówno punktowych, jak i rozproszonych.
- Zarządzanie gatunkami inwazyjnymi:
- Kontrola inwazyjnych gatunków, takich jak małże i makrofity, które konkurują z P. complanata.
- Dostosowanie praktyk zarządzania rzekami:
- Zmiana praktyk zarządzania rzekami, aby uniknąć szkód dla organizmów bentosowych, w tym małży słodkowodnych.
- Plan działania:
- Opracowanie i wdrożenie planu działania, który określi kierunki przyszłych działań ochronnych.
- Edukacja i świadomość:
- Działania informacyjne i edukacyjne na temat znaczenia gatunku oraz usług ekosystemowych, które zapewnia.
Potrzebne badania
- Identyfikacja populacji priorytetowych do ochrony.
- Badania nad zagrożeniami i ekologią gatunku.
- Długoterminowy monitoring populacji, aby śledzić trendy ilościowe i skuteczność działań ochronnych.

4. Unio nanus
Gatunek Unio nanus został ostatnio wpisany na Czerwoną Listę Gatunków Zagrożonych Międzynarodowej Unii Ochrony Przyrody w 2024 r. Gatunek Unio nanus znajduje się na liście gatunków zagrożonych
Zasięg geograficzny
Unio nanus to gatunek endemiczny dla Europy, którego główny zasięg obejmuje dorzecza Rodanu, Renu i Dunaju. Jego występowanie rozciąga się od tych dorzeczy do kanału La Manche, Morza Północnego oraz dorzeczy Morza Bałtyckiego, od rzeki Sekwany na zachodzie po Wisłę i Dunaj na wschodzie.
Status populacji
- Holandia: Gatunek ten jest uważany za wymarły.
- Inne kraje: W kilku krajach zaobserwowano poważne spadki populacji.
populacja zdjęcie przedstawia bliski gatunek Bythinella compressa .Europejska Czerwona Lista. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Europejska Czerwona Lista. Lista gatunków zagrożonych w Polsce. Owady, grzyby, małże, ślimaki. Stan na 15 marca 2025 r
Unio nanus to gatunek małża słodkowodnego, który jest obecnie uważany za równie zagrożony jak Unio crassus na poziomie Unii Europejskiej i w wielu krajach europejskich. W całym swoim zasięgu liczba subpopulacji znacznie spadła, a gatunek ten doświadczył drastycznego spadku liczebności.
przyczyny spadku populacji
- Pierwsza fala spadku (lata 70. XX wieku):
- Spadek rozpoczął się w najbardziej uprzemysłowionych regionach Europy Zachodniej, gdzie intensywny rozwój rolnictwa i przemysłu doprowadził do zniszczenia siedlisk.
- Druga fala spadku (1980–2022):
- W krajach byłego bloku wschodniego modernizacja i intensyfikacja agroprzemysłu spowodowały dalsze pogorszenie warunków środowiskowych.
spadek liczebności w poszczególnych krajach
- Holandia: Gatunek wyginął.
- Francja: Odnotowano 42% spadek zasięgu występowania.
- Niemcy: Liczba subpopulacji spadła o ponad 65% w niektórych regionach, a gatunek ma najwyższe ryzyko wyginięcia na poziomie krajowym.
- Polska: W latach 90. liczba subpopulacji i osobników zmniejszyła się o ponad 60%.
podsumowanie
Szacuje się, że w ciągu ostatnich 60 lat (1962–2022) populacja Unio nanus w Europie zmniejszyła się o ponad 50%. Zagrożenia dla tego gatunku są dobrze znane i nadal rosną, co podkreśla pilną potrzebę działań ochronnych.
Siedlisko i Ekologia
wymagania siedliskowe
Gatunek ten zamieszkuje czyste ekosystemy rzeczne z płynącą wodą i zróżnicowanym podłożem, obejmującym piasek, żwir i drobny osad denny. Preferuje miejsca przy brzegach rzek i strumieni, zwłaszcza stożki napływowe oraz obszary pod osłoną naturalnych przeszkód, takich jak korzenie i głazy. Choć jest odporny na fale powodziowe, może również występować w stabilnym osadzie w środkowych i głębszych partiach koryta, najczęściej w małych strumieniach.
Gatunek ten jest wrażliwy na zmiany chemii wody, zwłaszcza wysokie stężenia azotanów i fosforanów, a także na degradację naturalnych systemów rzecznych oraz zmiany w składzie gatunkowym ichtiofauny.
Jego populacje funkcjonują zgodnie z modelem metapopulacji – ławice małży mogą zanikać na danym obszarze i ponownie go kolonizować, co uzależnione jest od dostępności odpowiednich siedlisk.
Historia życia
Unio nanus wykazuje typowe dla rodziny Unionidae cechy rozrodcze, takie jak opieka rodzicielska nad larwami (wysiadywanie jaj) oraz pasożytnictwo larw na rybach słodkowodnych. Gatunek ten jest pośrednim żywicielem generalistą, co oznacza, że jego larwy mogą rozwijać się na różnych gatunkach ryb, takich jak Phoxinus phoxinus, Cottus gobio, Squalius cephalus, Gasterosteus aculeatus, Scardinius erythrophthalmus i Chondrostoma nasus. Jednak zgodność z żywicielami może się różnić w zależności od regionu geograficznego.
Ponieważ U. nanus został niedawno wydzielony jako odrębny gatunek od Unio crassus, wcześniejsze badania dotyczące żywicieli powinny zostać ponownie zweryfikowane, aby określić, które ryby rzeczywiście wspierają rozwój larw tego gatunku.
Długość życia U. nanus zależy od szerokości geograficznej, warunków klimatycznych i hydrologicznych siedliska. Może wynosić od 8 do 90 lat, ale zazwyczaj mieści się w przedziale 20–30 lat. Maksymalna długość ciała waha się od 5 do 11 cm, jednak przeważnie nie przekracza 8 cm.
Larwy, zwane glochidiami, są inkubowane w samicach w kilku lęgach i uwalniane od wiosny do lata, choć w zależności od populacji mogą występować różnice czasowe. Samice składają jaja w torbaczach już w połowie marca w południowej Polsce, natomiast na północy Europy proces ten następuje znacznie później.
Zapłodnienie odbywa się poprzez pobieranie spermatozeugmat (kul plemników) z wody przez samice. W Polsce samice składają zwykle trzy lęgi, choć mogą ich mieć nawet pięć, a wyjątkowo siedem. Czas inkubacji zależy od pory roku – wczesną wiosną trwa 20–30 dni, natomiast później skraca się do około 10 dni. Tarło może trwać do początku sierpnia.
Naturalna śmiertelność jest najwyższa wiosną i maleje w kolejnych miesiącach. Na zimę małże zakopują się w osadach dennych, gdzie chronią się pod warstwą liści i innych osadów, zazwyczaj w pobliżu brzegów rzek.
zagrożenia
Unio nanus to gatunek endemiczny dla Europy, którego główny zasięg obejmuje dorzecza Rodanu, Renu i Dunaju. Jest klasyfikowany jako zagrożony (A2ac) zarówno globalnie, jak i w państwach członkowskich UE. Szacuje się, że w ciągu ostatnich trzech pokoleń (około 45 lat) liczebność populacji zmniejszyła się o ponad 50% w całym zasięgu występowania.
główne przyczyny spadku populacji
- Zanieczyszczenie wody: Gatunek ten jest wrażliwy na zmiany w chemii wody, szczególnie na wysokie stężenia azotanów (powyżej 10 mg/l), które uniemożliwiają rozmnażanie.
- Zmiany siedliskowe:
- Budowa tam, drenaż i złe zarządzanie rzekami.
- Sedymentacja, która wpływa na jakość siedlisk.
- Drapieżnictwo:
- Rodzime drapieżniki: Wydra europejska (Lutra lutra).
- Gatunki inwazyjne: Piżmak (Ondatra zibethicus), nutria (Myocastor coypus), szop (Procyon lotor) i norka amerykańska (Neovison vison).
wpływ na rekrutację
- Spadek liczebności ryb żywicielskich: Degradacja siedlisk i zwiększone drapieżnictwo zmniejszyły skuteczność rekrutacji nowych pokoleń małży.
- Wrażliwość młodych osobników: Młode osobniki są szczególnie wrażliwe na zmiany w chemii wody.
tolerancja na eutrofizację
- Gatunek ten jest tolerancyjny na umiarkowany poziom eutrofizacji w naturalnie czystych rzekach, ale wymaga stabilnych warunków środowiskowych do przetrwania.
jedzenie
Gatunek ten jest wykorzystywany jako pasza dla drobiu w Rumunii. W niektórych częściach zasięgu jego występowania występuje również spożycie przez ludzi.
Ślimaki

1. Źródlarka żywiecka. (Bythinella zyvionteki)
Źródlarka żywiecka Bythinella zyvionteki została ostatnio oceniona pod kątem wpisu na Czerwoną Listę Gatunków Zagrożonych IUCN w 2009 r. Bythinella zyvionteki jest wymieniona jako gatunek zagrożony
zasięg geograficzny
Bythinella zyvionteki jest gatunkiem ślimaka słodkowodnego znanym jedynie z dwóch stanowisk położonych w niewielkiej odległości od siebie (mniej niż 10 km), w pobliżu Chechła na Wyżynie Krakowsko-Częstochowskiej w Polsce.
Jego siedlisko znajduje się na obrzeżach obszaru silnie przekształconego przez działalność przemysłową, obejmującą wydobycie węgla i rud metali oraz hutnictwo cynku i ołowiu. W ostatnich dekadach warunki w lokalizacji typowej uległy znacznemu pogorszeniu – odpływ wody jest coraz mniejszy, a otwarte wcześniej środowisko zostało zarośnięte przez drzewa i krzewy, co zmienia mikroklimat i dostępność zasobów dla tego gatunku.
populacja
Brak aktualnych informacji na temat populacji i trendów.
siedlisko i ekologia
Bythinella zyvionteki jest gatunkiem ślimaka słodkowodnego, zasiedlającym jurajskie formacje wapienne. Preferuje środowiska z czystą wodą, osiedlając się głównie na kamieniach oraz wśród osadów wapiennych w niewielkich ciekach wodnych i źródłach krasowych. Jego występowanie jest ściśle związane z wysoką jakością wody, stabilnymi warunkami hydrologicznymi oraz specyficznym składem chemicznym podłoża. Zmiany w przepływie wody, jej zanieczyszczenie oraz sukcesja roślinności w jego siedliskach mogą negatywnie wpływać na populację tego gatunku.
biologia gatunku
Bythinella zyvionteki jest gatunkiem o powolnym tempie wzrostu i niewielkiej liczbie potomstwa. Jest rozdzielnopłciowy, a jego cykl życiowy obejmuje stadium jajowe oraz postać larwalną rozwijającą się w wodzie, zanim osiągnie formę dorosłą. Ślimak ten żywi się głównie detrytusem i mikroorganizmami rozwijającymi się na powierzchni kamieni i roślin wodnych. Jest wrażliwy na zmiany w składzie chemicznym wody, zwłaszcza na podwyższone stężenia azotanów i metali ciężkich.
morfologia
Ślimak ten posiada niewielką, stożkowatą muszlę o wysokości do kilku milimetrów, z wyraźnymi, regularnie zwiniętymi skrętami. Muszla jest cienkościenna, gładka lub lekko rzeźbiona, w kolorze od jasnobrązowego do żółtawego. Otwór muszli jest owalny, a wieczko rogowe, stosunkowo cienkie. Ciało ślimaka jest jasne, półprzezroczyste, z dobrze rozwiniętymi czułkami i oczami umieszczonymi u nasady czułków.
zagrożenia
Bythinella zyvionteki jest gatunkiem proponowanym do kategorii zagrożonych. Znany jest jedynie z dwóch lokalizacji, w tym z lokalizacji typowej, które znajdują się na obrzeżach silnie zurbanizowanego i zanieczyszczonego obszaru przemysłowego. Region ten jest intensywnie eksploatowany przez górnictwo węgla i rudy oraz hutnictwo cynku i ołowiu. Dodatkowym zagrożeniem mogą być również zanieczyszczenia związane z rolnictwem, zwłaszcza wysokie stężenia azotanów.
W ciągu ostatnich 20 lat warunki siedliskowe w lokalizacji typowej uległy znacznemu pogorszeniu. Odpływ wody zmniejszył się, a dawniej otwarta przestrzeń została zarośnięta drzewami i krzewami, co mogło wpłynąć na dostępność i jakość siedliska dla tego gatunku.
Obecność B. zyvionteki w silnie uprzemysłowionym obszarze sprawia, że jest on szczególnie narażony na negatywne skutki działalności człowieka, takie jak zmiany hydrologiczne, degradacja siedlisk oraz zanieczyszczenie chemiczne wód powierzchniowych i gruntowych.
źródło:
- Dodelin, B., Alexander, K., Aleksandrowicz, O., Istrate, P., Jansson, N., Merkl, O., Pettersson, R., Schlaghamersky, J. & Telnov, D. 2017. Pseudogaurotina excellens. The IUCN Red List of Threatened Species 2017: e.T90344071A90344073. https://dx.doi.org/10.2305/IUCN.UK.2017-3.RLTS.T90344071A90344073.en. Accessed on 12 March 2025.
- Falniowski, A. 2011. Bythinella zyvionteki . Czerwona lista gatunków zagrożonych IUCN 2011: e.T155486A4785718. https://dx.doi.org/10.2305/IUCN.UK.2011-1.RLTS.T155486A4785718.en . Dostęp 15 marca 2025 r .
- Horák, J., Tezcan, S., Mico, E., Schmidl, J. & Petrakis, P. 2010. Ropalopus ungaricus. The IUCN Red List of Threatened Species 2010: e.T157487A5079917. https://dx.doi.org/10.2305/IUCN.UK.2010-1.RLTS.T157487A5079917.en. Accessed on 11 March 2025.
- iNaturalist. (n.d.). Bogatek Wspaniały [Buprestis splendens] March 12, 2025, https://www.inaturalist.org/observations/231185769
- iNaturalist. (n.d.). Cheilosia hercyniae. iNaturalist. Retrieved March 11, 2025, https://www.inaturalist.org/taxa/1417266-Cheilosia-hercyniae
- iNaturalist. (n.d.). Kompleks Unio crassus [Observation]. Retrieved March 14, 2025, from https://www.inaturalist.org/observations/264395003
- Insektarium (n.d.). Melanogaster curvistylus I. Retrieved March 12, 2025 https://insektarium.net/diptera-2/syrphidae/melanogaster-curvistylus/
- Insektarium (n.d.). Nakwiecień. I. Retrieved March 12, 2025, https://insektarium.net/diptera-2/syrphidae/brachyopa-grunewaldensis-nakwiecien-kniejak/
- Insektarium. (n.d.). Sphegina montana. Retrieved March 9, 2025, https://insektarium.net/diptera-2/syrphidae/sphegina-montana/
- Instytut Ochrony Przyrody PAN. (n.d.). Buprestis splendens Fabricius, 1775 – Bogatek wspaniały https://www.iop.krakow.pl/pckz/opisa362.html?id=141&je=pl
- Instytut Ochrony Przyrody PAN. (n.d.). Polska Czerwona Księga Zwierząt: Limoniscus violaceus. https://www.iop.krakow.pl/pckz/opis5925.html?id=53&je=pl
- Janković, M. & Vujić, A. 2021. Cheilosia pini. The IUCN Red List of Threatened Species 2021: e.T149163589A149163591. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149163589A149163591.en. Accessed on 11 March 2025.
- Jordal, J. 2022. Gloioxanthomyces vitellinus (poprawiona wersja oceny z 2019 r.). Czerwona lista gatunków zagrożonych IUCN 2022: e.T147322131A218989359. https://dx.doi.org/10.2305/IUCN.UK.2022-2.RLTS.T147322131A218989359.en . Dostęp 14 marca 2025 r .
- Kałucka, I.L. & Svetasheva, T. 2019. Fomitopsis officinalis. The IUCN Red List of Threatened Species 2019: e.T75104087A75104095. https://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T75104087A75104095.en. Accessed on 13 March 2025.
- Krisai-Greilhuber, I. 2019. Flaviporus citrinellus . Czerwona lista gatunków zagrożonych IUCN 2019: e.T147295216A147880737. https://dx.doi.org/10.2305/IUCN.UK.2019-2.RLTS.T147295216A147880737.en . Dostęp 13 marca 2025 r .
- Lopes-Lima, M., Prié, V., Aldridge, D.C. & Urbańska, M. 2024. Pseudanodonta complanata. The IUCN Red List of Threatened Species 2024: e.T211999791A212006932. https://dx.doi.org/10.2305/IUCN.UK.2024-1.RLTS.T211999791A212006932.en. Accessed on 14 March 2025.
- Lopes-Lima, M., Prié, V., Österling, M. & Zając, TA 2024. Unio crassus . Czerwona lista gatunków zagrożonych IUCN 2024: e.T210291828A215467836. https://dx.doi.org/10.2305/IUCN.UK.2024-1.RLTS.T210291828A215467836.en . Dostęp 14 marca 2025 r .
- Lopes-Lima, M. & Prié, V. 2024. Unio nanus . Czerwona lista gatunków zagrożonych IUCN 2024: e.T215447310A215447388. https://dx.doi.org/10.2305/IUCN.UK.2024-1.RLTS.T215447310A215447388.en . Dostęp 14 marca 2025 r .
- Mason, F., Campanaro, A., Horák, J., Istrate, P., Munteanu, N., Büche, B., Tezcan, S., Méndez, M. & Dodelin, B. 2020. Buprestis splendens (poprawiona wersja oceny z 2010 r.). Czerwona lista gatunków zagrożonych IUCN 2020: e.T3334A166538784. https://dx.doi.org/10.2305/IUCN.UK.2020-1.RLTS.T3334A166538784.en . Dostęp 12 marca 2025 r .
- Méndez, M., Dodelin, J., Petrakis, P., Schlaghamersky, J. & Nardi, G. 2010. Limoniscus violaceus. The IUCN Red List of Threatened Species 2010: e.T157572A5098447. https://dx.doi.org/10.2305/IUCN.UK.2010-1.RLTS.T157572A5098447.en. Accessed on 11 March 2025.\
- Mešić, A. 2019. Cystoderma carpaticum . Czerwona lista gatunków zagrożonych IUCN 2019: e.T147163725A147862860. https://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T147163725A147862860.en . Dostęp 13 marca 2025 r .
- Miličić, M. & Vujić, A. 2021. Cheilosia loewi . Czerwona lista gatunków zagrożonych IUCN 2021: e.T149167337A149167349. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149167337A149167349.en . Dostęp 13 marca 2025 r .
- Moorkens, E., Cordeiro, J., Seddon, MB, von Proschwitz, T. & Woolnough, D. 2017. Margaritifera margaritifera (wersja erraty opublikowana w 2018 r.). Czerwona Lista Gatunków Zagrożonych IUCN 2017: e.T12799A128686456. https://dx.doi.org/10.2305/IUCN.UK.2017-3.RLTS.T12799A508865.en . Dostęp: 14 marca 2025 r .
- Moser, M. M. (n.d.). Cystoderma carpaticum. In The Global Fungal Red List. Retrieved March 14, 2025, from https://redlist.info/iucn/species_view/312524
- Soldati, F., Alexander, K., Legakis, A., Liberto, A., Makris, C., Merkl, O., Pettersson, R., Schlaghamersky, J. & Vazquez, X. 2020. Corticeus bicoloroides (amended version of 2017 assessment). The IUCN Red List of Threatened Species 2020: e.T87328451A176224554. https://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T87328451A176224554.en. Accessed on 11 March 2025.
- Speight, M. C. D. (2011). Species accounts of European Syrphidae (Diptera). Syrph the Net: The Database of European Syrphidae (Vol. 65). Glasgow.
- Ståhls, G. & Janković, M. 2021. Cheilosia alba . Czerwona lista gatunków zagrożonych IUCN 2021: e.T149164551A149164553. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149164551A149164553.en . Dostęp 11 marca 2025 r .
- Ståhls, G. & Vujić, A. 2021. Cheilosia crassiseta. The IUCN Red List of Threatened Species 2021: e.T149164329A149164331. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149164329A149164331.en. Accessed on 11 March 2025.
- Ståhls, G., Miličić, M. & Vujić, A. 2021. Cheilosia hercyniae. The IUCN Red List of Threatened Species 2021: e.T149164215A149164217. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149164215A149164217.en. Accessed on 11 March 2025.
- Syrphidae Community. (n.d.). Syrphidae: Hoverflies of the world. Retrieved March 11, 2025, from https://www.syrphidae.com/
- van der Ent, L.-J., van Steenis, J. & van Steenis, W. 2021. Neoascia unifasciata. The IUCN Red List of Threatened Species 2021: e.T149165245A149165248. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149165245A149165248.en. Accessed on 12 March 2025.
- van Steenis, J., van Steenis, W. & van der Ent, L.-J. 2021. Brachyopa grunewaldensis . Czerwona lista gatunków zagrożonych IUCN 2021: e.T149171321A149171323. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149171321A149171323.en . Dostęp 12 marca 2025 r .
- van Steenis, W., van Steenis, J. & van der Ent, L.-J. 2021. Melanogaster curvistylus . Czerwona lista gatunków zagrożonych IUCN 2021: e.T149169562A149169572. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149169562A149169572.en . Dostęp 12 marca 2025 r .
- van Steenis, W., van Steenis, J. & van der Ent, L.-J. 2021. Orthonevra plumbago. The IUCN Red List of Threatened Species 2021: e.T149171258A149171261. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149171258A149171261.en. Accessed on 12 March 2025.
- Vujić, A. & Likov, L. 2021. Cheilosia montana. The IUCN Red List of Threatened Species 2021: e.T149163975A149163977. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149163975A149163977.en. Accessed on 11 March 2025.
- Vujić, A., Likov, L. & Tot, T. 2021. Cheilosia morio. The IUCN Red List of Threatened Species 2021: e.T149167289A149167292. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149167289A149167292.en. Accessed on 11 March 2025.
- Vujić, A. & Likov, L. 2021. Cheilosia nivalis. The IUCN Red List of Threatened Species 2021: e.T149167246A149167248. https://dx.doi.org/10.2305/IUCN.UK.2021-3.RLTS.T149167246A149167248.en. Accessed on 11 March 2025.